热化学方程式及其书写
时间:2014-12-06 19:27 来源:未知 作者:陈恒 点击: 次 所属专题: 热化学方程式
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
热化学方程式是表示化学反应中的物质变化和焓变。
一、热化学方程式的书写
与普通化学方程式相比,书写热化学方程式除了遵循书写普通化学方程式外,还应该注意以下几点:
(1)反应热ΔH与测定的条件(温度、压强)有关,同一个化学反应,在不同温度或压强下进行时,所产生的热效应一般不同,因此书写热化学方程式时,要注明应热ΔH的测定条件。在25℃、101kPa时的化学反应热通常称为标准反应热,一般不注明反应的温度和压强时,即为此条件下的反应热。
(2)同一个化学反应,由于聚集状态不同,反应热数值不同,因此热化学方程式必须注明每个反应物和生成物的聚集状态,反应热ΔH一般写在热化学方程式的右边。放热为负值,吸热为正值,单位为kJ·mol-1。聚集状态固体用“s”、液体用“l”、气体用“g”、溶液用“aq”等表示,只有这样才能完整地体现出热化学方程式的意义。热化学方程式中不标“↑”或“↓”。
(3)对于具有同素异形体的物质,除了要注明聚集状态之外,还要注明物质的名称。如:
S(s,单斜)+O2(g)=SO2(g);△H1=-297.16kJ/mol
S(s,正交)+O2(g)=SO2(g);△H2=-296.83kJ/mol
(4)热化学方程式中各物质化学式前面的化学计量数仅表示该物质的物质的量,不表示物质的分子数或原子数(意为若干个分子参加反应的热效应是难以测量的),因此化学计量数可以是整数,也可以是分数。
(5)热化学方程式是表示反应已完成的数量。由于ΔH与反应完成物质的量有关,所以方程式中化学前面的化学计量系数必须与ΔH相对应,如果化学计量系数加倍,那么ΔH也加倍。当反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
(6)在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热叫中和热。书写中和热的化学方程式应以生成1mol水为基准。
(7)反应热可分为多种,如燃烧热、中和热、溶解热等,在25℃、101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。
二、热化学方程式的计算
(1)根据能量:△H=E总(生成物)-E总(反应物)
(2)根据键能:△H=E总(断键)-E总(成键)
(3)燃烧热:Q(放)=n(可燃物)·△H(燃烧热)
(4)中和热:Q(放)=n(H2O)·△H(中和热)
(5)将ΔH看作是热化学方程式中的一项,再按普通化学方程式的计算步骤、格式进行计算,得出有关数据。
(6)如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的,即盖斯定律:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与反应的途径无关。可表示为:△H=△H1+△H2+△H3
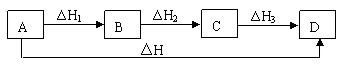
三、叠加法求热化学方程式中的焓变
首先观察已知的热化学方程式与目标热化学方程式的差异:
(1)若目标热化学方程式中的反应物在某个已知热化学方程式中作生成物(或目标方程式中的某种生成物在某个已知方程式中作反应物),可把该热化学方程式的反应物和生成物颠倒,相应的△H改变符号。
(2)将每个已知的热化学方程式两边同乘以某个合适的数,使已知热化学方程式中某种反应物或生成物的化学计量系数与目标热化学方程式中的该反应物或生成物的化学计量系数一致。热化学方程式中的△H也进行相应的换算。
(3)将已知热化学方程式进行叠加,相应的热化学方程式中的△H也进行叠加。

- 全部评论(0)
