化学反应热计算的几种方法介绍
时间:2018-10-08 20:55 来源:未知 作者:化学自习室 点击: 次 所属专题: 反应热计算
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
(一)根据热化学方程式计算
若题目给出了相应的热化学方程式,其计算方法与根据一般方程式相似,可以把ΔH看成方程式内的一项进行处理,反应热与反应物中各物质的物质的量成正比;若没有给出热化学方程式,则根据条件先写出热化学方程式,再计算反应热。
例1.卫星发射时燃料燃烧的热化学方程式如下:2N2H4(g)+2NO2(g)===3N2(g)+4H2O(g) ΔH=-1135.7KJ/mol,求16g N2H4(g)完全燃烧放热多少?
解:2N2H4(g)+2NO2(g)===3N2(g)+4H2O(g) ΔH=-1135.7KJ/mol
2mol 1135.7KJ
16/32mol Q
得:Q=283.925KJ
(二)根据反应物和生成物的能量计算
ΔH=生成物总能量-反应物总能量
例2.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:上图是N2和H2反应生成2mol NH3过程中能量变化示意图,
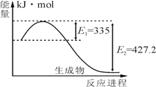
请计算每生成4mol NH3放出热量为____________。
解:根据公式ΔH=生成物总能量-反应物总能量得:
ΔH=E2-E1=a-b=335-427.2=92.2KJ
故生成4mol NH3放出热量为92.2×2=184.4KJ
(三)根据燃烧热计算反应热:
Q(放)=n(可燃物)×|ΔH|
例3.液态苯的燃烧热ΔH=-3267.5KJ/mol,在25℃、101.KPa时,1kg 苯充分燃烧后放出多少热量?
解:1kg 苯的物质的量n=1000÷78=12.8mol
再根据公式:Q(放)=n(可燃物)×|ΔH|=12.8×|-3267.5|=41824KJ
(四)根据反应物和生成物的键能计算:
ΔH=∑E(反应物)-∑E(生成物),即反应热等于反应物的键能总和跟生成物的键能总和之差。
例4.以下是部分共价键键能数据H-S:364KJ·mol-1,S-S:266KJ·mol-1,S=O:522KJ·mol-1,H-O:464KJ·mol-1,试根据这些数据计算下面这个反应的焓变。2H2S(g)+SO2(g)=3S(s)+2H2O(l) ΔH=_____(提示:反应产物中的S实为S8,实际分子是8元环状分子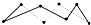 )。
)。
解析:根据题图8mol S形成8mol S—S,可推知平均1mol S含有1mol。再根据ΔH=∑E(反应物)-∑E(生成物)=4×364KJ·mol-1+2×522KJ·mol-1—3×266KJ·mol-1—4×464KJ·mol-1=-154KJ/mol
故:ΔH=-154KJ/mol
(五)根据盖斯定律计算反应热:
一找:找出目标热化学方程式中未出现的而已知热化学方程式中出现的中间物质。
二配:给找出的中间物质配系数,使其在不同的已知热化学方程式中化学计量数保持一致。
三消:将配好系数的热化学方程式进行相加或相减,以消去找出的中间物质。
四算:依据消去中间物质的方式将ΔH进行相加或相减即可数出目标热化学方程式的反应热。
例5.2012年6月16日我国成功发射了“神州九号”.这标志着中国人的太空时代又前进了一大步.发射“神九”时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气.已知:
N2(g)+2O2(g)=2NO2(g) ΔH1=+67.7KJ/mol①
N2H4(g)+O2(g)=N2(g)+2H2O(g);ΔH2=KJ/mol②
求2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);ΔH3③
解析:通过观察发现③式未出现而①、②出现的中间物是O2,再者①式O2的计量数为2而②式为1,故将②×2使O2的化学计量数一致;为了消去O2且使N2H4作反应物,所以通过②×2—①即可得到③。
得:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);ΔH3=2ΔH2—ΔH1=2×(-534)—67.7=-1135.7KJ/mol

- 全部评论(0)
