题型突破:工艺流程专题
时间:2020-02-04 12:43 来源:未知 作者:化学自习室 点击:次 所属专题: 工艺流程
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、物质转化中“核心反应”方程式的书写
陌生反应方程式的书写思路
首先根据题给材料中的信息写出部分反应物和生成物的化学式,再根据反应前后元素化合价有无变化判断反应类型:
(1)元素化合价无变化则为非氧化还原反应,遵循质量守恒定律。
(2)元素化合价有变化则为氧化还原反应,除遵循质量守恒外,还要遵循得失电子守恒规律。最后根据题目要求写出化学方程式或离子方程式(需要遵循电荷守恒规律)即可。
角度一 化工流程中的“离子反应”
1.归纳化工流程题中主要涉及的5类离子反应
(1)难溶物溶解的离子反应
①ZnCO3溶于稀硫酸:ZnCO3+2H+=== Zn2++H2O+CO2↑
②Cr(OH)3溶于盐酸:Cr(OH)3+3H+===Cr3++3H2O
③Al(OH)3溶于强碱:Al(OH)3+OH-===AlO![]() +2H2O
+2H2O
(2)沉淀转化的离子反应
①Zns转化为CuS:ZnS+Cu2+ CuS+Zn2+
CuS+Zn2+
②AgCl转化为AgI:AgCl+I- AgI+Cl-
AgI+Cl-
③Mg(OH)2转化为Fe(OH)3:3Mg(OH)2+2Fe3+ 2Fe(OH)3+3Mg2+
2Fe(OH)3+3Mg2+
(3)同种元素在同种价态、不同pH下转化的离子反应
①CrO![]() 在酸性条件下转化为Cr2O
在酸性条件下转化为Cr2O![]() :
:
2CrO![]() +2H+===Cr2O
+2H+===Cr2O![]() +H2O
+H2O
②V2O5在酸浸时转化为VO![]() :
:
V2O5+2H+===2VO![]() +H2O
+H2O
③Cr(OH)3在碱性条件下转化为Cr(OH)![]() :
:
Cr(OH)3+OH-=== Cr(OH)![]()
(4)与量有关的离子反应
①向Ca(OH)2溶液中滴加NaHCO3溶液
NaHCO3溶液少量:
HCO![]() +OH-+Ca2+===CaCO3↓+H2O
+OH-+Ca2+===CaCO3↓+H2O
NaHCO3溶液过量:
2HCO![]() +2OH-+Ca2+===CaCO3↓+CO
+2OH-+Ca2+===CaCO3↓+CO![]() +2H2O
+2H2O
②向NaHSO4溶液中滴加Ba(OH)2溶液
加Ba(OH)2溶液至SO![]() 恰好沉淀:
恰好沉淀:
H++OH-+SO![]() +Ba2+===BaSO4↓+H2O
+Ba2+===BaSO4↓+H2O
加Ba(OH)2溶液至溶液呈中性:
2H++2OH-+SO![]() +Ba2+===BaSO4↓+2H2O
+Ba2+===BaSO4↓+2H2O
(5)涉及氧化还原反应的离子反应
①KMnO4与盐酸反应生成MnCl2和Cl2:
2MnO![]() +10Cl-+16H+===2Mn2++5Cl2↑+8H2O
+10Cl-+16H+===2Mn2++5Cl2↑+8H2O
②碱性条件下NaClO将Fe(OH)3氧化为NA2FeO4:
2Fe(OH)3+3ClO-+4OH-===2FeO![]() +3Cl-+5H2O
+3Cl-+5H2O
2.反思书写离子方程式时的注意事项
(1)观察离子方程式中的符号是否正确、合理,如不可逆反应用“===”,可逆反应用“??”,气体符号为“↑”,沉淀符号为“↓”。
(2)离子方程式中必须用化学式表示的物质有难溶于水的物质(如AgCl、BaSO4等)、难电离的物质(如弱酸、弱碱等)、非电解质(如SO2、CO2等)。
(3)离子方程式中的微溶物[如Ca(OH)2等]有时用化学式表示,有时用离子符号表示。作为反应物时,若为澄清溶液则写离子符号,若是浊液则写化学式;作为生成物时一般写化学式。
(4)注意酸式盐中酸式酸根离子的书写方式,多元弱酸的酸式酸根离子,在离子方程式中不能拆开写,如NaHCO3在水溶液中的离子是NA+和HCO![]() ,其中HCO
,其中HCO![]() 不能拆写成H+和CO
不能拆写成H+和CO![]() ;而多元强酸的酸式酸根离子在水溶液中可完全电离,如NaHSO4在水溶液中的离子为NA+、H+和SO
;而多元强酸的酸式酸根离子在水溶液中可完全电离,如NaHSO4在水溶液中的离子为NA+、H+和SO![]() 。
。
(5)注意灵活应用电荷守恒及氧化还原反应中的得失电子守恒,判断离子方程式是否正确。
角度二 化工流程中的“氧化还原反应”
1.把握陌生氧化还原反应方程式的书写步骤

2.学会氧化还原反应产物的判断
(1)常见氧化剂及其还原产物
氧化剂 | Cl2(X2) | O2 | Fe3+ | 酸性KMnO4 | MnO2 | 酸性K2Cr2O7 | HClO |
还原产物 | Cl-(X-) | H2O/O2-/ OH- | Fe2+ | Mn2+ | Mn2+ | Cr3+ | Cl- |
氧化剂 | ClO | 浓H2SO4 | HNO3 | H2O2(H+) | PbO2 | FeO | NaBiO3 |
还原产物 | Cl- | SO2 | NO2(浓)、NO(稀) | H2O | Pb2+ | Fe3+ | Bi3+ |
(2)常见还原剂及其氧化产物
还原剂 | 金属单质 | Fe2+ | H2S、S2- | SO2/SO | HI/I- | NH3 | N2H4 | CO |
氧化产物 | 金属离子 | Fe3+ | S、SO2 | SO3、SO |
| N2、NO | N2 | CO2 |
二、化工流程中实验操作分析与物质成分确定
1.工艺流程中的实验操作分析
(1)流程中的“操作步骤”
操作步骤 | 高频设问 | 答题指导 |
原料处理 | 如何提高“浸出率”? | ①将矿石粉碎;②适当加热加快反应速率;③充分搅拌;④适当提高浸取液的浓度等 |
分析“浸出率”图表,解释“浸出率”高低变化的原因(“浸出率”升高一般是反应温度升高,反应速率加快;但当“浸出率”达到最大值后,温度升高“浸出率”反而下降,一般是反应试剂的分解或挥发)。选择达到一定较高“浸出率”的时间及温度(注意:一般不止一个答案) | ||
焙烧 | ①高温下硫化物与空气中氧气反应(如FeS2与氧气生成氧化铁和二氧化硫);②除去硫、碳单质;③有机物转化(如蛋白质燃烧)、除去有机物等 | |
酸性气体的吸收 | 常用碱性溶液吸收(如SO2用Na2CO3或NaOH溶液吸收) | |
控制条件 | 除去杂质的方法 | 加氧化剂,转变金属离子的价态(如Fe2+→Fe3+) |
调节溶液的pH | 调溶液pH常用氢氧化钠、碳酸钠、金属氧化物[还有酸性气体(二氧化硫)、稀盐酸或稀硫酸]等。常利用题给金属离子沉淀的pH信息,使特定金属离子以氢氧化物沉淀出来 | |
物质转化的分析 | 跟踪物质,分析每一步骤中可能发生的化学反应,书写化学方程式或离子方程式 | |
滤渣、滤液中物质的判断,书写物质的化学式或电子式,分析物质中的化学键 | ||
确定循环物质 | ||
物质分离 | 过滤、蒸发结晶、重结晶、分液与萃取 | 仪器的选择(如玻璃仪器的选择) |
结晶方法: ①晶体不带结晶水,如NaCl、KNO3等;蒸发结晶 ②晶体带结晶水,如胆矾等;将滤液蒸发浓缩、冷却结晶、过滤 ③要得到溶解度受温度影响小的溶质,如除去NaCl中少量的KNO3:蒸发浓缩结晶,趁热过滤 ④要得到溶解度受温度影响大的溶质,如除去KNO3中少量的NaCl:蒸发浓缩、冷却结晶、过滤 | ||
晶体的洗涤 | 用乙醇等有机溶剂洗涤晶体的目的:可以除去晶体表面可溶性的杂质和水分、减少晶体溶解损耗,利用乙醇的易挥发性,有利于晶体的干燥 |
(2)流程中的“操作目的”
操作目的 | 答题指导 | |||
固体原料进行“粉碎” | 减小颗粒直径,增大浸取时的反应速率,提高浸取率 | |||
酸(或碱)溶 | ①原料经酸(或碱)溶后转变成可溶物进入溶液中,以达到与难溶物分离的目的 ②用碱性溶液吸收酸性气体原料 | |||
灼烧(焙烧) | ①除去硫、碳单质;②有机物转化、除去有机物;③高温下原料与空气中氧气反应等 | |||
金属用热碳酸钠溶液洗涤 | 除去金属表面的油污 | |||
过滤 | 固体与液体的分离;要分清楚需要的物质在滤液中还是在滤渣中。滤渣是难溶于水的物质,如SiO2、PbSO4、难溶的金属氢氧化物和碳酸盐等 | |||
萃取与分液 | 选用合适的萃取剂(如四氯化碳、金属萃取剂),萃取后,静置、分液——将分液漏斗玻璃塞的凹槽与分液漏斗口的小孔对准。下层液体从下口放出,上层液体从上口倒出 | |||
加入氧化剂(或还原剂) | ①转化为目标产物的价态 ②除去杂质离子(如把Fe2+氧化成Fe3+,而后调溶液的pH,使其转化为Fe(OH)3沉淀除去) | |||
加入沉淀剂 | ①生成硫化物沉淀(如加入硫化钠、硫化铵、硫化亚铁等) ②加入可溶性碳酸盐,生成碳酸盐沉淀 ③加入氟化钠,除去Ca2+、Mg2+ | |||
判断能否加其他物质 | 要考虑是否引入杂质(或影响产物的纯度)等 | |||
在空气中或在其他气体中进行的反应或操作 | 要考虑O2、H2O、CO2或其他气体是否参与反应;能否达到隔绝空气、防氧化、防水解、防潮解等目的 | |||
调溶液pH | ①生成金属氢氧化物,以达到除去金属离子的目的 ②抑制盐类水解 ③促进盐类水解生成沉淀,有利于过滤分离 ④用pH计测量溶液的pH ⑤用pH试纸测定溶液的pH:将一小块pH试纸放在洁净干燥的玻璃片或表面皿上,用洁净的玻璃棒蘸取少量待测液点在pH试纸的中部,待试纸变色后再与标准比色卡对照读数 | |||
控制温度 | ①控制物质的溶解与结晶 ②防止某些物质分解或挥发(如H2O2、氨水、草酸) ③控制反应速率、使催化剂达到最大活性、防止副反应的发生 ④控制化学反应的方向,使化学平衡移动 ⑤煮沸:促进溶液中的气体(如氧气)挥发逸出 ⑥趁热过滤:减少因降温而析出的溶质的量 | |||
洗涤晶体 | 洗涤试剂 | 适用范围 | 目的 | |
蒸馏水 | 冷水 | 产物不溶于水 | 除去固体表面吸附着的××杂质;可适当降低固体因为溶解而造成的损失 | |
热水 | 有特殊的物质其溶解度随着温度升高而下降 | 除去固体表面吸附着的××杂质;可适当降低固体因为温度变化溶解而造成的损失 | ||
有机溶剂(酒精、丙酮等) | 固体易溶于水、难溶于有机溶剂 | 减少固体溶解;利用有机溶剂的挥发性除去固体表面的水分,产品易干燥 | ||
饱和溶液 | 对纯度要求不高的产品 | 减少固体溶解 | ||
酸、碱溶液 | 产物不溶于酸、碱 | 除去固体表面吸附着的可溶于酸、碱的杂质;减少固体溶解 | ||
洗涤沉淀方法:向过滤器中加入蒸馏水至浸没沉淀,待水自然流下后,重复以上操作2~3次 | ||||
提高原子利用率 | 绿色化学(物质的循环利用、废物处理、原子利用率、能量的充分利用) | |||
2.流程中物质成分的确定
(1)循环物质的确定
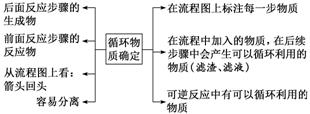
(2)副产品的判断
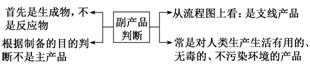
(3)滤渣、滤液成分的确定
要考虑样品中原料和杂质的成分在每一步骤中与每一种试剂反应的情况:
①反应过程中哪些物质(离子)消失了?
②所加试剂是否过量或离子间发生化学反应,又产生了哪些新离子?要考虑这些离子间是否会发生反应。
三、化工流程题中的“流程分析”
1.流程题的结构图解
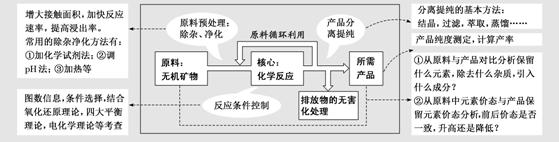
2.流程图图解
[示例] (2019·惠州模拟)活性氧化锌是一种新型多功能无机材料。某小组以粗氧化锌(含铁、铜的氧化物)为原料模拟工业生产活性氧化锌,步骤如下:
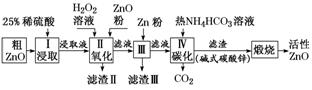
已知各相关氢氧化物沉淀pH范围如下表所示:
Zn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀pH | 5.4 | 7.0 | 2.3 | 4.7 |
完全沉淀pH | 8.0 | 9.0 | 4.1 | 6.7 |
请回答下列问题:
(1)步骤Ⅱ中加入H2O2溶液的作用是______________(用离子方程式表示)。
(2)用ZnO调节pH,以除去含铁杂质,调节pH的适宜范围是________________。
(3)步骤Ⅲ中加入Zn粉的作用是:①________________;②进一步调节溶液pH。
(4)碱式碳酸锌[Zn2(OH)2CO3]煅烧的化学方程式为________________________________。
[流程图解]
流程图中各步主要转换如下:
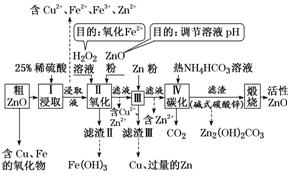
解析:(1)根据上图转换关系可知,加入H2O2溶液的作用是将溶液中的Fe2+氧化成Fe3+,其离子方程式为2Fe2++H2O2+2H+===2Fe3++2H2O。(2)加入ZnO调节pH的目的是使Fe3+完全沉淀,而使Cu2+不沉淀,需控制溶液pH的范围为4.1≤pH<4.7。(3)Zn粉能与溶液中的Cu2+发生置换反应,除去Cu2+;Zn粉还能与过量的稀硫酸反应,进一步调节溶液的pH。(4)煅烧碱式碳酸锌生成ZnO、CO2和H2O,其化学方程式为Zn2(OH)2CO3![]() 2ZnO+CO2↑+H2O。
2ZnO+CO2↑+H2O。
答案:(1)2Fe2++H2O2+2H+===2Fe3++2H2O
(2)4·1~4.7
(3)除去溶液中的Cu2+
(4)Zn2(OH)2CO3![]() 2ZnO+CO2↑+H2O
2ZnO+CO2↑+H2O

- 全部评论(0)
