苯甲酸的重结晶解读
时间:2020-02-15 14:49 来源:未知 作者:淮畔化学 点击: 次 所属专题: 重结晶05 苯甲酸
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、实验目的
1、熟悉有机物重结晶提纯的原理和应用。
2、掌握折叠滤纸的作用与折叠方法。
3、掌握有机物重结晶提纯的基本步骤和操作方法。
4、了解称量、溶液配制等基本实验操作技能。
二、实验原理
无论是天然的或有机合成的固体化合物,往往是不纯的,夹杂着少量的其它化合物,通常称为杂质。从有机合成反应分离出来的固体粗产物往往含有未反应的原料、副产物及杂质,必须加以分离纯化。纯化这类固体物质的有效而简便的方法是用合适的溶剂进行重结晶。这是每个有机化学工作者应该掌握的最有用的实验技巧之一。
重结晶是利用被提纯物和杂质的溶解度及各自在混合物中的含量不同而进行的一种分离纯化方法。绝大多数固体化合物在溶剂中的溶解度随温度的升高而增大,随温度的下降而减小。通常混合物中,被提纯物为主要成分,其含量较高,容易配制成热的饱和溶液,而此时杂质则远未达到饱和溶液。因此,当热的饱和溶液冷却时,被提纯的物质由于溶解度下降会结晶出来,而杂质则全部或部分留在溶液中(若杂质在溶剂中的溶解度极小,则配成热饱和溶液后被过滤除去),这样便达到了提纯的目的。
重结晶适用于提纯杂质含量在5%以下的固体化合物,杂质含量过多,常会影响提纯效果,须经多次重结晶才能提纯。因此,常用其它方法如:水蒸气蒸馏,萃取等手段先将粗产品初步化,然后再用重结晶法提纯。
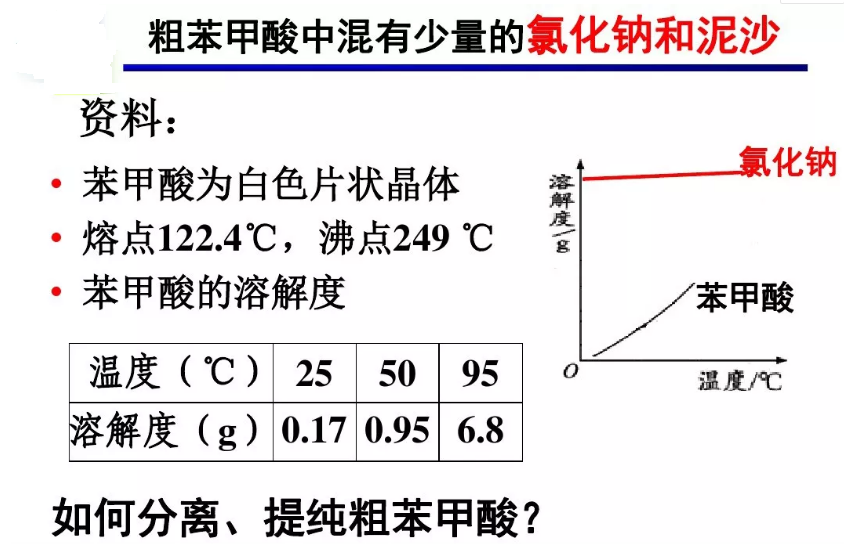
利用物质中各组分在同一溶剂中的溶解性能不同而将杂质除去。苯甲酸在水中的溶解度随温度的变化较大,通过重结晶可以使它与杂质分离,从而达到分离提纯的目的。

三、实验仪器与试剂
试剂:粗苯甲酸(本实验中的药品混有氯化钠和少量泥沙),蒸馏水 。
仪器:烧杯、铁架台(带铁圈)、酒精灯、普通漏斗、布氏漏斗、铜漏斗、玻璃棒、抽滤瓶、滤纸、石棉网、火柴。
四、实验步骤

(一)溶解
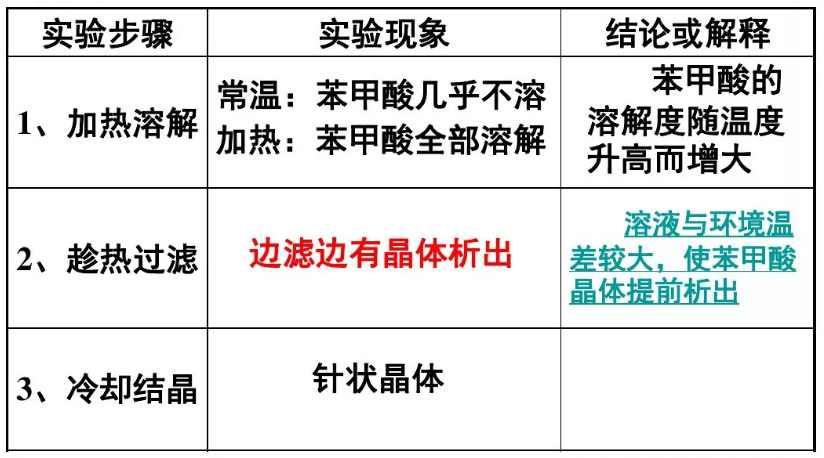
1、取约3g粗苯甲酸晶体置于100mL烧杯中,加入40mL蒸馏水若有未溶固体,可再酌加少量热水,直至苯甲酸全部溶解为止(如不全溶,可再加入3~5mL热水,加热搅拌使其溶解。但要注意,如果加水加热后不能使不溶物减少,说明不溶物可能是不溶于水的杂质,就不要再加水,以免误加过多溶剂)。
2、铁架台上垫一张石棉网,将烧杯放在石棉网上,点燃酒精灯加热,不时用玻璃棒搅拌。
3、待粗苯甲酸全部溶解,停止加热,冷却后加入几粒活性炭,继续加热煮沸5分钟。
(二)过滤
1、将准备好的铜漏斗放在铁架台的铁圈上,漏斗下放一小烧杯,点燃酒精灯加热,在漏斗里放一张折叠好的折叠滤纸,并用少量热水润湿。这时将上述热溶液尽快地沿玻璃棒倒入漏斗中,每次倒入的溶液不要太满,也不要等溶液滤完后再加。所有溶液过滤完毕后,用少量热水洗涤锥瓶和滤纸。
2、将烧杯中的混合液趁热过滤。过滤时可用坩埚钳夹住烧杯,避免烫手,使滤液沿玻璃棒缓缓注入过滤器中。
资料补充(过滤):
过滤有常压和减压两种,其基本要求是避免溶液在过滤过程中出现结晶,因此,应尽可能缩短过滤时间和采取过滤过程中的溶液保温措施。
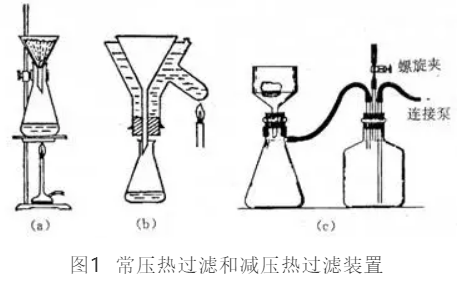
(1)常压热过滤:这是利用折叠滤纸和预热的短颈玻璃漏斗进行的重力过滤法。漏斗预热方法有两种:沸腾溶剂直接预热,适用于水溶剂,装置如图1a;用保温热水漏斗套保温过滤,适用于所有溶剂,装置及加热方法如图1b。保温漏斗夹层中的水量一般为其容积的2/3。过滤前应预先将其加热到所需要的温度,然后熄灭火源即可起到保温过滤作用。
(2)减压过滤:又称为抽滤,其装置如图1c所示。其特点是过滤快,但缺点是容易引起低沸点溶液的沸腾而改变溶液浓度,导致结晶过早析出,所以要尽量减少热滤过程中的溶剂损失。
减压抽滤使用的是布氏漏斗(Buchner)。所用滤纸大小应和布氏漏斗底部恰好合适,然后用水润湿滤纸,使滤纸与漏斗底部贴紧。如果所要抽滤样品需要在无水条件下过滤时,需先用水贴紧滤纸,用无水溶剂洗去滤纸上水分(例如用乙醇或丙酮),确信已将水分除净后再进行过滤。减压抽紧滤纸后,迅速将热溶液倒入布氏漏斗中,在过滤过程中漏斗里应一直保持有较多的溶液。在末过滤完以前不要抽干,同时瓶内压力不宜抽的过低,为防止由于压力过低,溶液沸腾而沿抽气管跑掉,可用手稍稍捏住抽气管,使吸滤瓶中仍保持一定的真空度,而能继续迅速抽滤。
(三)冷却结晶
将滤液静置冷却,观察烧杯中晶体的析出。待结晶完全析出后,用布氏漏斗抽滤,并用少量冷蒸馏水洗涤结晶,以除去结晶表面的母液。洗涤时,先从吸滤瓶上拔去橡皮管,然后加入少量冷蒸馏水,使结晶体均匀浸透,再抽滤至干。如此重复洗涤2次。
(四)将得到的苯甲酸晶体进行称量,并计算产率。
资料补充(实验步骤):
饱和溶液的配制:称取2g粗苯甲酸,加入到150mL 烧杯中,加入120mL 水和几粒沸石,盖上合适的小漏斗或表面皿,在石棉网上加热至沸,并用玻璃棒不断搅动,观察固体溶解情况,如溶解不完,可加入少量的水,直到溶解完全为止 (不溶性杂质除外)。如有颜色,可冷却溶液后,加入适量活性炭,搅拌后再加热煮沸5-10min。
保温过滤:利用预先加热到约100℃的保温漏斗进行保温过滤。如一次未能倒完溶液,需注意加热保温。过滤完后,用少量热水洗涤锥形瓶和残渣。静置滤液,使其自然结晶。
固液分离:用布氏漏斗抽滤后,用少量热蒸馏水洗涤结晶,抽滤吸干,并如此重复两次。
结晶干燥:将结晶摊放在表面皿或滤纸上,放入 80℃以下烘箱中干燥。称重,计算回收率。
五、实验注意事项:
1、重结晶所用溶剂的选择与要提纯的物质不起化学反应;对被提纯的有机物质必须具备溶解度在热时较大,而在较低温度时则较小的特性;对杂质的溶解度非常大或非常小,溶解度大者使杂质留在母液中,不与被提纯物一道析出结晶;溶解度小者使杂质在热过滤时被除去;对要提纯的物质能生成较整齐的晶体;溶剂的沸点,不宜太低,也不宜太高。当过低时,溶解度改变不大,操作又不易,过高时,附着于晶体表面的溶剂不易除去。在几种溶剂同样都合适时,则应根据结晶的回收率,操作的难易,易燃性和价格等来选择。
2、若溶液中有颜色可用活性炭来进行脱色,活性炭的用量应视杂质的多少而定,一般为干燥粗产品重量的1-5%。活性炭不能直接加入正沸腾的溶液中,否则将造成暴沸而溅出。
3、冷却应完全,要达到室温,防止损失。
4、在加热溶解粗苯甲酸的同时,要准备好热水,铜漏斗,以便趁热过滤。

资料补充:选择溶剂
正确选择溶剂是进行重结晶的前提,对于确保重结晶纯化目的的实现,具有重要的意义。理想的重结晶溶剂应具备以下条件:
①不与被提纯物质发生化学反应;
②提纯物质在该溶剂中的溶解度,随温度的变化有显著的差异。一般在溶剂沸点附近的溶解度比室温时至少要大3倍。
③溶剂对被提纯物和杂质的溶解度差异较大。最好是杂质在热溶剂中的溶解度很小(热过滤时可除去)。或者在低温时溶解度很大,冷却后不会随样品结晶出来。
④被提纯物质在溶剂中能够形成良好的结晶。
⑤溶剂容易挥发,易与结晶分离,便于蒸馏回收,沸点一般在 30℃- 50℃之间为宜。注意,溶剂的沸点不得高于被提纯物的熔点。否则当溶剂沸腾时,样品会熔化为油状,给纯化带来麻烦。
⑥纯度高,价格低,易得到,毒性小,使用安全。
溶剂的选择,目前尚无可靠的规律可循,但“相似相溶”原则,在粗选时还是适用的。
具体选择最佳溶剂,还应通过实验筛选。方法如下:
取0.1g 待提纯的固体物质置于试管中,加入1mL 待选溶剂,振摇。如在室温下样品全溶解,则说明溶解度过大,不能使用;如不溶,可加热至沸,振荡后观察,还不溶时,可分批每次加入0.5mL 溶剂,每次加液后均加热煮沸,振荡观察,记录所用溶剂的毫升数,当总量达3mL后仍不溶解,说明试样在该溶剂中难溶,也不适用;只有当溶剂的量在 2-3mL 内,试样能全溶于沸腾的溶剂中,且在冷却后有较多的结晶析出者,方可作为结晶的候选溶剂。通常要做出几种溶剂试验,相互比较,选出结晶速度适当,产率高者,作为最佳溶剂。

- 全部评论(0)
(18952531175) 评论 href="/plus/view.php?aid=17999">苯甲酸的重结晶解读:太强了太强了太强了太强了太强了
