有机化学中的常用氧化剂——过氧乙酸
时间:2021-02-23 12:32 来源:未知 作者:化学自习室 点击: 次 所属专题: 过氧乙酸
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
含有不同官能团(比如醚,醇,酯,酮和氨基等)的烯烃,一些芳香化合物,呋喃,硫化物,胺等。它还可以在催化剂存在下氧化烯烃。
【英文名称】Peracetic Acid
【分子式】C2H4O3
【分子量】76.05
【CA登录号】[79-21-0]
【缩写和别名】过醋酸,过乙酸
【结构式】CH3COOOH
【物理性质】mp 0℃, bp 25 ℃/12 mmHg, d=1.038 g/cm3。过氧乙酸为无色透明液体,弱酸性,易挥发,有强烈刺激性气味,并带有很强的乙酸气味。易溶于水和有机溶剂,溶解性与乙酸相似。温度较高时放出氧气,加热到110℃时,强烈爆炸。
【制备和商品】过氧乙酸的实验室制备一般是在催化剂量(质量分数1%)的硫酸存在下,由乙酸与H2O2反应得到。其商品在各大试剂公司可以购买到。常见的有40%的乙酸溶液(d 1.15g/cm3),也有它的乙酸乙酯溶液。出于安全的考虑,过氧乙酸一般不会制成纯物质。商品化的过氧乙酸包含乙酸,水,H2O2,H2SO4等。
【注意事项】过氧乙酸是爆炸性物质,但是当在有机溶剂中浓度小于55%时,室温下操作是安全的。该试剂应该在通风橱中使用。使用时有必要准备一个安全护罩。应避光、密封、低温储存。
过氧乙酸是一种常见的氧化剂。它可以氧化简单烯烃,含有不同官能团(比如醚,醇,酯,酮和氨基等)的烯烃,一些芳香化合物,呋喃,硫化物,胺等。它还可以在催化剂存在下氧化烯烃。
烯烃的环氧化
在工业上,为了避免使用大量该试剂可能出现的危险,一般会原位制备它,以这种方式制备的过氧乙酸被广泛用来进行植物油和脂肪酸的环氧化。在搅拌条件下,在50 ℃ 左右的含有催化剂量硫酸(质量分数1%)的乙酸溶液的底物中逐渐加入50% 的H2O2,溶液中H2O2的浓度应保持同一数值,不再增大。过氧乙酸边生成边消耗 (式1)。H2O2一般2 h 滴完,反应温度也增大并保持在60℃左右直到所有的H2O2消耗完 (大约3 h)。反应溶液用水稀释,分离出不溶于水的环氧化物。由于催化剂硫酸对于过氧乙酸的快速形成是必需的,所以这种原位方法只适用于制备能在酸催化剂存在下稳定存在的环氧化物。如果反应完成的温度和时间控制恰当,则能够以很好的产率得到脂肪酸的环氧化物。
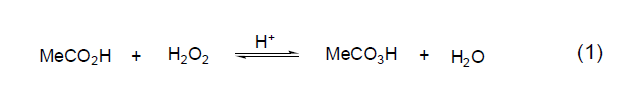
对于烯烃的环氧化反应而言,过氧乙酸的乙酸乙酯溶液是比乙酸溶液更好的反应试剂,这主要是因为大量的乙酸在后续反应中容易导致环氧化物开环。
由于双键上电子云密度低,端烯通过过氧乙酸环氧化的反应一般进行较缓慢。而用一些特殊的金属配合物则能完成缺电子结构烯烃的环氧化。以三价铁离子螯合物{[(phen)2-(H2O)FeIII]2(μ-O)}(ClO4)4为催化剂,过氧乙酸在0 ℃下,5分钟内就能以很高的产率氧化端烯而得到环氧化产物 (式2)。大多数烯烃都可以用于这个反应。这个反应的活性与溶液的pH有关,当pH ≤ 2时反应活性最好。二价锰离子配合物[MnII(R,R-mcp)(CF3SO3)2]也有类似的活性。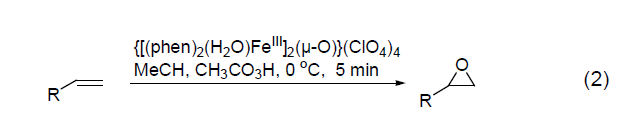
易分解的丙烯基环氧化物可以通过反应式3 所示方法制备。这个方法已经成功地用来从1,3-环戊二烯、1,3-庚二烯和1,3-辛二烯制备丙烯基环氧化物。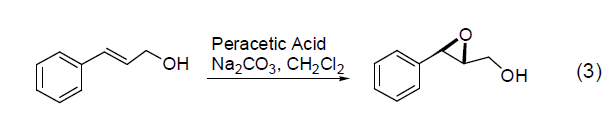
环氧化反应
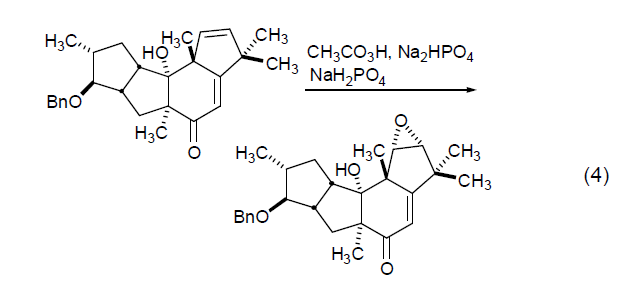
具有区域选择性和立体选择性,总是优先在电子云密度大的烯键上发生(式4)。二烯的环氧化具有区域选择性和立体选择性,反应位点是在较多取代的双键位阻较小的一侧。
呋喃的氧化
2,5-二取代呋喃可以通过过氧乙酸氧化断裂;苯并呋喃可以被过氧乙酸氧化为内酯 (式5)。
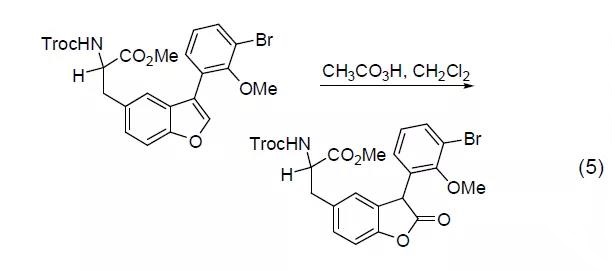
芳香化合物的氧化
某些取代芳香化合物可以被过氧乙酸有效地氧化为醌。如在Mn(III) 或者Fe(II) 的配合物催化下,萘和甲基萘被过氧乙酸氧化而得到萘醌 (式6)。
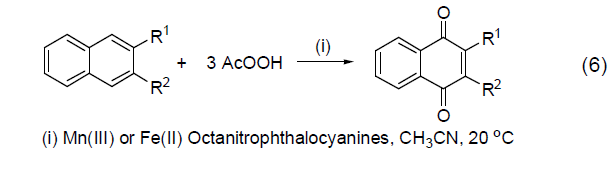
钌、锇催化氧化
在三氯化钌催化剂存在下,烯烃与过氧乙酸反应生成α-酮醇。这个反应必须在两相体系中进行。共轭双烯,烯丙基叠氮化物,α,β-不饱和酯 (式7)都可以被这种试剂氧化。
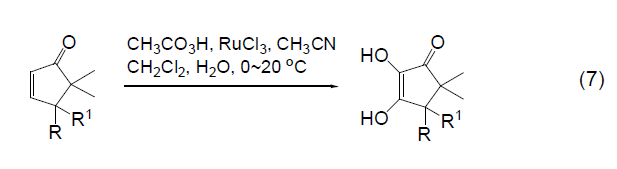
用 近年来,过氧乙酸还衍生出一些新的用途,如:将硫醚氧化为亚砜[10];烷硫基氧化为烷基亚磺酰基。氧化氮杂环,如把吡啶氧化为N-氧化胺。把硅烷氧化为羟基(式8)。


- 全部评论(0)
