构造原理与屏蔽效应、钻穿效应的关系
时间:2021-06-15 15:54 来源:未知 作者:化学自习室 点击: 次 所属专题: 构造原理
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
多电子体系中,电子不仅受到原子核的作用,而且受到其余电子的作用,故能量关系复杂。所以,多电子体系中,电子或轨道的能量不只由主量子数n决定,也与角量子数l有关。
1)屏蔽效应
主量子数n相同,角量子数l不同的原子轨道,l越大,能量越高。
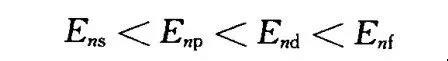
n相同l不同的原子轨道能量不相同,称为能级分裂。能级分裂可以用屏蔽效应解释。
由于内层电子抵消或中和掉部分正电荷,使被讨论的电子受核的引力下降,能量升高,称为屏蔽效应。由于多电子体系中屏蔽效应的存在,电子的能量为
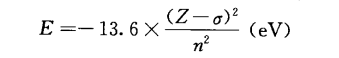
式中,σ为屏蔽常数,其大小与量子数n和l有关。
2)钻穿效应
对于n相同而l不同的轨道,由于电子云径向分布不同,电子穿过内层而钻穿到核附近回避其他电子屏蔽的能力不同,从而使其能量不同。各轨道的钻穿能力为ns>np>nd>nf,因此,轨道的能量顺序为Ems<Enp <End<Emf。
电子穿过内层轨道钻穿到核附近而使其能量降低,称为钻穿效应。钻穿效应能够解释能级分裂现象,也能够解释能级交错现象。
能级交错是指在多电子原子中,当主量子数n和角量子数l不同时,主量子数n大的轨道的能量反而比主量子数n小的轨道的能量低,如4s轨道能量低于3d轨道。
3)原子轨道近似能级图
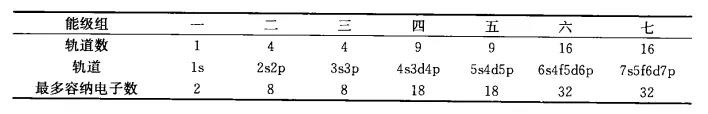
美国化学家鲍林根据光谱数据和近似的理论计算结果,提出了多电子原子的原子轨道近似能级图。鲍林将能级按照从低到高分为7个能级组:
4)科顿(Cotton)原子轨道能级图
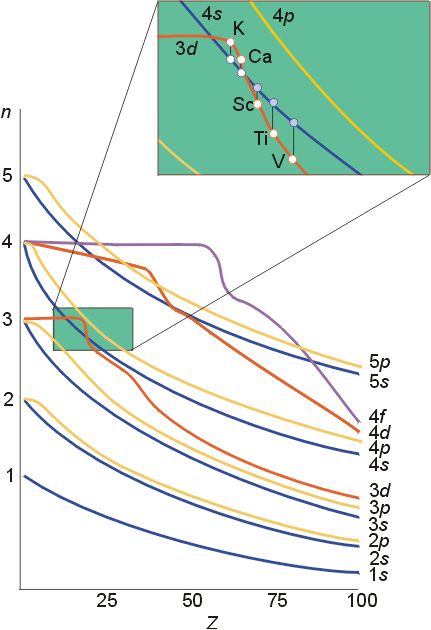
科顿认为,不同元素,轨道的能级次序不同,即不是所有元素都产生能级交错现象。例如,1~14号元素轨道能级E4S>E3d;15~20号元素轨道能级E4S<E3d;21号以后元素轨道能级E4S>E3d。
利用科顿原子轨道能级图能够解释失去电子的顺序。例如,Fe元素先失去4s轨道电子,而后失去3d轨道电子。但科顿原子轨道能级图不能解释为什么电子先填入4s轨道,而后才填入3d轨道。
5)斯莱特(Slater)规则
斯莱特规则,提供了一种半定量的计算屏蔽常数σ的方法,进而计算轨道和电子的能量:
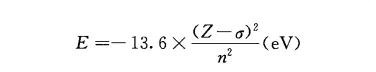
斯莱特规则将轨道分组为(1s)(2s 2p)(3s 3p)(3d)(4s 4p)(4d)(4f).....屏蔽常数σ计算原则如下:
①外层电子对内层电子无屏蔽,即右边各组轨道电子对左边轨道电子屏蔽常数σ=0。
②1s轨道组内的两个电子之间的屏蔽常数σ=0.30,其他同组电子之间的屏蔽常数σ=0.35。
③讨论(nsnp)组轨道的电子受到屏蔽时,(n-1)层轨道上的每个电子的屏蔽常数σ=0.85;(n-2)层及以内各层轨道的每个电子的屏蔽常数σ=1.00。
④讨论(nd)或(nf)组的轨道电子受到屏蔽时,所有左侧各组轨道电子的屏蔽常数均为σ=1.00。

- 全部评论(0)
