工艺流程的思维方法指导
时间:2022-04-07 10:09 来源:未知 作者:化学自习室 点击: 次 所属专题: 工艺流程题解题指导
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、工艺流程是核心考题:现阶段高考试题的构建理念
试题选取的情境紧密联系与人类密切相关的生产生活实际,试题的命制从情境素材开始,以学科素养为目标导向,选取某个学科素养的一个方面或几个方面,深入考查学生学科素养的表现层次。生产生活中的实际问题应围绕某一主题内容,突出化学核心知识与理念,与主旨考查的学科素养和关键能力相对应,形成多维度、多角度、多层次的问题结构。
利用与生活相关的稍微简单的实际问题,考查学生的简单应用能力和辨识能力。
利用科研前沿和生产实际的真实情境,展现研究过程或者生成过程的具体实际问题,考查学生的探究与创新能力。
二、工艺流程的命题特点
选取物质的工业生产流程,考查应用基础知识分析解决生产中的实际问题的能力以工业生产流程题的形式进行,符合新课改对情境素材的要求。
该类试题取材于真实的工业生产,根据考查内容和能力的需要,对物质的实际工业合成流程进行简化处理,设置基本概念、反应及转化、反应原理和实际工业操作等相关问题。
考查应用相关知识解决实际问题的能力
三、工艺流程的难点
对待教材有的内容:
1.对已有概念、原理的理解水平不足
2.对已有核心知识(概念)原理的提炼习惯不够
3.对实际问题情境中的迁移应用水平不高
对待教材没有的内容:
1.缺少研究物质和反应的基本思路——识
2.缺少实验感知与实践——做
3.缺少基于实证的反思与评价——思
四、正确识别流程
(1)呈现模式

(2)识图方法
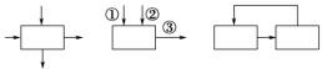
图1 图2 图3
图1箭头表示反应物加入同时生成物出来;
图2箭头表示反应物分步加入和生成物出来;
图3箭头表示循环反应。
五、整体分析-通读试题,弄清流程目的,明确步骤原因
处理试题时,切勿急于解答题中的设问(某些通用问题除外),要按“单主线法”的顺序,仔细认真地通读试题,从宏观上整体把握试题难度和考点,初步了解原料、目的和提供的一些课本上没有但题目中必须要用到的新信息。同时养成良好做题习惯,阅读时随手标记目的及相关信息。
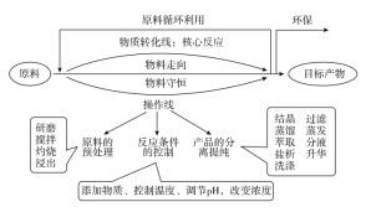
简单阅读后,应当深层次的提取流程图中的双主线(如黑白图所示):
一是反应线,即物质之间的转化关系(考虑复分解及氧化还原);
二是操作线,即物质在移动时所需的化学实验操作。此时,要千万注意:不要被极个别看不懂的细小环节蒙蔽双眼,此时尚且不必将每个环节的原理都搞清楚,也不必将每个物质都一推出。对于成绩好的同学可以将常见考查形式整理出来,看到题干的设问,来预测可能的设问的问题,做到未卜先知。
当然,在处理具体问题时要做到具体分析,综合使用主线法,双线法与三线法,最大程度上获取有用信息。
1.主线法分析:

(1)流程图一般三大部分(彩图):原料预处理、转化与分离阶段、获取最终产物阶段。
(2)流程中要分析“进”、“出”物质和仍然留在溶液中的离子等(否则可能漏掉副产品或干扰离子)。
(3)一般默认进入的物质过量,确保每一步目标元素利用率或转化率最高,产品产率最高,损失最小。当然在某些特殊情况下要控制用量。
2.双线法分析:
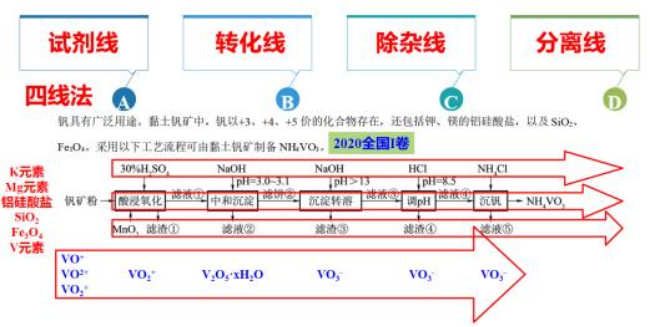
3.四线法分析:
试剂线:为达到最终目的加入的物质,起到氧化还原、非氧化还原的作用;
转化线:元素守恒—焙烧、溶浸、沉淀、煅烧、电解、结晶等;
除杂线:复分解沉淀、置换沉淀、氧化还原沉淀;加热产生气体等;
分离线:蒸发、结晶、过滤(趁热过滤)、洗涤、干燥等。
六、局部分析—抓住关键,找准命题角度,做到步步为营
通过整体分析,弄清化学工艺流程图的主要目的之后,要按题设中的问题要求,再次回头仔细分析、研究化学工艺流程中与问题相关的局部过程,有针对性地解决题设中提出的每一个问题。此时,针对一些生涩的“化工术语”,可能会阻碍对试题的有效解读,应该进行针对性的讲解、步骤性强的思维训练,明确快速有效的解题策略,哪些术语是不可或缺的哪些是迷惑眼球的。
(1)两个明确
①明确干扰设置的规律:对于陌生的干扰因素,通常是为了使整个化学工艺流程结构完整而设置的,在题设的问题中没有涉及或者不影响答题,此时可以跳过,跟着流程往下一步看,关注的重点应是其产物,对于陌生因素可以看前后流程的信息来大胆猜测。
②明确以问题为导向的分析:工艺流程题设中的问题顺序通常与流程图的流程顺序是一致的,且一个问题对应流程图的一个或依次相连的若干个环节,做题时只需找到所需回答的问题与流程图中相关信息的一一对应关系,“顺藤摸瓜”就可以有效解决相关问题。
(2)抓住关键,找准角度
①抓住关键词,流程图或题干中的关键词是分析和解决问题的直接证据。
预处理阶段-研磨(或粉碎)、灼烧(或焙烧、煅烧)、浸出(水浸、酸浸、碱洗)、搅拌,
核心反应阶段-氧化(或还原)、除杂(加入(或多或正好)沉淀剂、调控溶液的pH或范围控制反应温度、加入保护气),
分离提纯阶段—结晶与过滤、洗涤与干燥、脱水(的各种不同方法),
后续阶段—滴定计算,转化率计算,产率计算,质量分数计算。
②找准角度,分析设问的角度对功底要求高,此时如果找准角度,就可以轻松的获得信息,明确答题方向。
基本理论(氧化还原反应、化学平衡、盐类水解、电化学)
控制反应条件(温度、催化剂、压强、原料配比、调节溶液的pH、选择溶剂、除杂、产品分离)绿色化学(循环操作、环境保护、原子经济)
经济角度(原料的利用率高、提高产物的产率或产量、降低能耗)
安全生产(防止污染、爆炸、中毒等)。
七、落笔成句—构建模型,规范答题,获得最大收益
流程的最终目的就是收益最大化,解决流程题同理,在分析完问题后,如何正确的书写是得分的关键,此时针对性的“技巧”“套路”“模板”就必须拿出来了。
(1)获得收益最大化
工艺流程和其他问题不同,它的前后设问经常关联不大,前一问未作答,往往不会影响后面问题的作答。因此,在解答时,不会解答的问题要战略性的放弃,先把能得到的分数得到,对于之前未解决的问题,回过头来还是带着问题看信息来寻找答案。考试的时候,以得分为第一任务。
(2)大量训练,构建模型
①想到答案不要急于书写,要思考:答题角度,信息储备,建立模型②积累各类实验操作的固定答题模式,明确答题的规矩和规则;③注重文字、化学用语表达的准确性、严密性、科学性,力求做到答案层次分明,因果清晰。
八、见微知著-明知错误,提前预警,避免低级失误
①答非所问-审题不清,抓不住关键字词句,过滤掉关键答题要求,甚至指鹿为马;
②不遵守学科规范-不用化学原理分析,语言描述太随意,不会使用学科语言;
③基本功欠缺-乱用化学用语表述,书写极为不规范;
④答题毛糙-丢三落四,比如容量瓶不指明规格,物理量漏写计量单位,电子式遗漏孤对电子,方程式未配平、漏写反应条件、沉淀气体符号等。
九、命题训练-动手绘制流程图,体会出题人的意图
利用某含铬废液【含较低浓度浓度的Na2Cr2O7、Fe2(SO4)3】制备K2Cr2O7流程如下:
1.用NaOH溶液调pH至3.6,产生红褐色沉淀,过滤;
2.向滤液中加入Na2SO3,一定操作后分离出Na2SO4·10H2O;
3.将分离出Na2SO4·10H2O后的溶液调pH约为5,得到Cr(OH)3沉淀;
4.在KOH存在条件下,向Cr(OH)3中加入足量H2O2溶液,得到黄色溶液;
5.向黄色溶液中加入物质a后,溶液变为橙红色,一定操作后得到K2Cr2O7固体;
6.测定K2Cr2O7,固体的纯度。
建议设置的设问:
(1)原料的处理阶段时的条件控制
(2)反应方程式的书写
(3)pH与沉淀溶解平衡结合的计算题
(4)反应方程式的书写
(5)分离提纯操作
(6)纯度计算
十、典型工艺流程题
【2021全国乙卷26题】磁选后的炼铁高钛炉渣,主要成分有TiO2、SiO2、Al2O3、MgO、CaO以及少量的Fe2O3。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。

该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表
| 金属离子 | Fe3+ | Al3+ | Mg2+ | Ca2+ |
开始沉淀的pH | 2.2 | 3.5 | 9.5 | 12.4 |
沉淀完全的pH | 3.2 | 4.7 | 11.1 | 13.8 |
回答下列问题:
(1)“焙烧”中,TiO2、SiO2几乎不发生反应,Al2O3、MgO、CaO、Fe2O3转化为相应的硫酸盐,写出Al2O3转化为NH4Al(SO4)2的化学方程式__________。
(2)“水浸”后“滤液”的pH约为2.0,在“分步沉淀”时用氨水逐步调节pH至11.6,依次析出的金属离子是_________________。
(3)“母液①"中Mg2+浓度为______mol/L。
(4)“水浸渣”在160℃“酸溶”最适合的酸是____________。“酸溶渣”的成分是____________、____________。
(5)“酸溶”后,将溶液适当稀释并加热,TiO2+水解析出TiO2·xH2O沉淀,该反应的离子方程式是______________。
(6)将“母液①”和“母液②”混合,吸收尾气,经处理得_____,循环利用。
【答案】(1)Al2O3+4(NH4)2SO4 NH4Al(SO4)2+4NH3↑+3H2O
NH4Al(SO4)2+4NH3↑+3H2O
(2)Fe3+、Al3+、Mg2+
(3)1×10-6
(4)硫酸SiO2、CaSO4
(5)TiO2++(x+1)H2O TiO2·xH2O+2H+
TiO2·xH2O+2H+
(6)(NH4)2SO4
【分析】由题给流程可知,高钛炉渣与硫酸铵混合后焙烧时,二氧化钛和二氧化硅不反应,氧化铝、氧化镁、氧化钙、氧化铁转化为相应的硫酸盐,尾气为氨气;将焙烧后物质加入热水水浸,二氧化钛、二氧化硅不溶于水,微溶的硫酸钙部分溶于水,硫酸铁、硫酸镁和硫酸铝铵溶于水,过滤得到含有二氧化钛、二氧化硅、硫酸钙的水浸渣和含有硫酸铁、硫酸镁、硫酸铝铵和硫酸钙的滤液;向pH约为2.0的滤液中加入氨水至11.6,溶液中铁离子、铝离子和镁离子依次沉淀,过滤得到含有硫酸铵、硫酸钙的母液①和氢氧化物沉淀;向水浸渣中加入浓硫酸加热到160℃酸溶,二氧化硅和硫酸钙与浓硫酸不反应,二氧化钛与稀硫酸反应得到TiOsO4,过滤得到含有二氧化硅、硫酸钙的酸溶渣和TiOsO4溶液;将TiOsO4溶液加入热水稀释并适当加热,使TiOsO4完全水解生成TiO2·xH2O沉淀和硫酸,过滤得到含有硫酸的母液②和TiO2·xH2O。
【解析】(1)氧化铝转化为硫酸铝铵发生的反应为氧化铝、硫酸铵在高温条件下反应生成硫酸铝铵、氨气和水,反应的化学方程式为
Al2O3+4(NH4)2SO4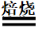 NH4Al(SO4)2+4NH3↑+3H2O;
NH4Al(SO4)2+4NH3↑+3H2O;
(2)由题给开始沉淀和完全沉淀的pH可知,将pH约为2.0的滤液加入氨水调节溶液pH为11.6时,铁离子首先沉淀、然后是铝离子、镁离子,钙离子没有沉淀;
(3)由镁离子完全沉淀时,溶液pH为11.1可知,氢氧化镁的溶度积为1×10-5×(1×10-2·9)2=1×10-10·8,当溶液pH为11.6时,溶液中镁离子的浓度为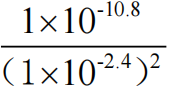 =1×10-6mol/L;
=1×10-6mol/L;
(4)增大溶液中硫酸根离子浓度,有利于使微溶的硫酸钙转化为沉淀,为了使微溶的硫酸钙完全沉淀,减少TiOsO4溶液中含有硫酸钙的量,应加入浓硫酸加热到160℃酸溶;由分析可知,二氧化硅和硫酸钙与浓硫酸不反应,则酸溶渣的主要成分为二氧化硅和硫酸钙;
(5)酸溶后将TiOSO4溶液加入热水稀释并适当加热,能使TiOSO4完全水解生成TiO2·xH2O沉淀和硫酸,反应的离子方程式为
TiO2++(x+1)H2O TiO2·xH2O+2H+;
TiO2·xH2O+2H+;
(6)由分析可知,尾气为氨气,母液①为硫酸铵、母液②为硫酸,将母液①和母液②混合后吸收氨气得到硫酸铵溶液,可以循环使用。
【2020新课标Ⅰ卷26题】钒具有广泛用途。黏土钒矿中,钒以+3、+4、+5价的化合物存在,还包括钾、镁的铝硅酸盐,以及SiO2、Fe3O4。采用以下工艺流程可由黏土钒矿制备NH4VO3。
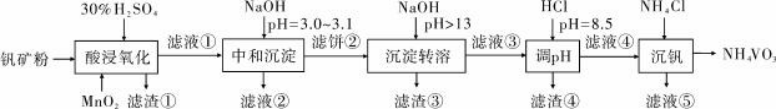
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | Fe3+ | Fe2+ | Al3+ | Mn2+ |
开始沉淀pH | 1.9 | 7.0 | 3.0 | 8.1 |
完全沉淀pH | 3.2 | 9.0 | 4.7 | 10.1 |
回答下列问题:
(1)“酸浸氧化”需要加热,其原因是__________。
(2)“酸浸氧化”中,VO+和VO2+被氧化成VO2+,同时还有___________离子被氧化。写出VO+转化为VO2+反应的离子方程式________。
(3)“中和沉淀”中,钒水解并沉淀为V2O5.xH2O,随滤液②可除去金属离子K+、Mg2+、Na+、___________,以及部分的___________。
(4)“沉淀转溶”中,V2O5![]() xH2O转化为钒酸盐溶解。滤渣③的主要成分是________。
xH2O转化为钒酸盐溶解。滤渣③的主要成分是________。
(5)“调pH”中有沉淀生产,生成沉淀反应的化学方程式是_____________。
(6)“沉钒”中析出NH4VO3晶体时,需要加入过量NH4Cl,其原因是__________。
【答案】
(1)加快酸浸和氧化反应速率(促进氧化完全)
(2)Fe2+ ; VO++MnO2+2H+=VO2++Mn2++H2O
(3)Mn2+ 、 Al3+和Fe3+
(4)Fe(OH)3
(5)NaAl(OH)4+HCl=Al(OH)3↓+NaCl+H2O
(6)利用同离子效应,促进NH4VO3尽可能析出完全
【分析】
黏土钒矿中,钒以+3、+4、+5价的化合物存在,还包括钾、镁的铝硅酸盐,以及SiO2、Fe3O4,用30%H2SO4和MnO2“酸浸氧化”时VO+和VO2+被氧化成VO2+,Fe3O4与硫酸反应生成的Fe2+被氧化成Fe3+,SiO2此过程中不反应,滤液①中含有VO2+、K+、Mg2+、Al3+、Fe3+、Mn2+、SO42-;滤液①中加入NaOH调节pH=3.0~3.1,钒水解并沉淀为V2O5·xH2O,根据表中提供的溶液中金属离子开始沉淀和完全沉淀的pH,此过程中Fe3+部分转化为Fe(OH)3沉淀,部分Al3+转化为Al(OH)3沉淀,滤液②中含有K+、Na+、Mg2+、Al3+、Fe3+、Mn2+、SO42-,滤饼②中含V2O5·xH2O、Fe(OH)3、Al(OH)3,滤饼②中加入NaOH使pH>13,V2O5·xH2O转化为钒酸盐溶解,Al(OH)3转化为NaAlO2,则滤渣③的主要成分为Fe(OH)3;滤液③中含钒酸盐、偏铝酸钠,加入HCl调pH=8.5,NaAlO2转化为Al(OH)3沉淀而除去;最后向滤液④中加入NH4Cl“沉钒”得到NH4VO3。
【解析】
(1)“酸浸氧化”需要加热,其原因是:升高温度,加快酸浸和氧化反应速率(促进氧化完全),故答案为:加快酸浸和氧化反应速率(促进氧化完全);
(2)“酸浸氧化”中,钒矿粉中的Fe3O4与硫酸反应生成FeSO4、Fe2(SO4)3和水,MnO2具有氧化性,Fe2+具有还原性,则VO+和VO2+被氧化成VO2+的同时还有Fe2+被氧化,反应的离子方程式为MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;VO+转化为VO2+时,钒元素的化合价由+3价升至+5价,1mol VO+失去2mol 电子,MnO2被还原为Mn2+,Mn元素的化合价由+4价降至+2价,1mol MnO2得到2mol 电子,根据得失电子守恒、原子守恒和电荷守恒,VO+转化为VO2+反应的离子方程式为VO++MnO2+2H+=VO2++Mn2++H2O,故答案为:Fe2+,VO++MnO2+2H+=VO2++Mn2++H2O;
(3)根据分析,“中和沉淀”中,钒水解并沉淀为V2O5·xH2O,随滤液②可除去金属离子K+、Mg2+、Na+、Mn2+,以及部分的Fe3+、Al3+,故答案为:Mn2+,Fe3+、Al3+;
(4)根据分析,滤渣③的主要成分是Fe(OH)3,故答案为:Fe(OH)3;
(5)“调pH”中有沉淀生成,是NAAlO2与HCl反应生成Al(OH)3沉淀,生成沉淀反应的化学方程式是NaAlO2+HCl+H2O=NaCl+Al(OH)3↓或Na[Al(OH)4]+HCl=NaCl+Al(OH)3↓+H2O,故答案为:NaAlO2+HCl+H2O=NaCl+Al(OH)3↓或Na[Al(OH)4]+HCl=NaCl+Al(OH)3↓+H2O。
(6)“沉钒”中析出NH4VO3晶体时,需要加入过量NH4Cl,其原因是:增大NH4+离子浓度,利用同离子效应,促进NH4VO3尽可能析出完全,故答案为:利用同离子效应,促进NH4VO3尽可能析出完全。

- 全部评论(0)
