如何认识锂离子电池的工作原理?
时间:2022-07-28 22:03 来源:追寻化学教育的本源 作者:化学自习室 点击: 次 所属专题: 锂离子电池
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
锂离子电池(如图 2-3 所示)是指采用可以可逆地嵌入与脱嵌锂离子的变价金属化合物做为正极、采用可以可逆地插入与脱插锂离子的材料做为负极,从而通过锂离子在正负极之间的迁移来工作的二次电池。由于电池充电与放电时,锂离子是在正、负极间进行交换,故锂离子电池又称为 摇椅式电池。
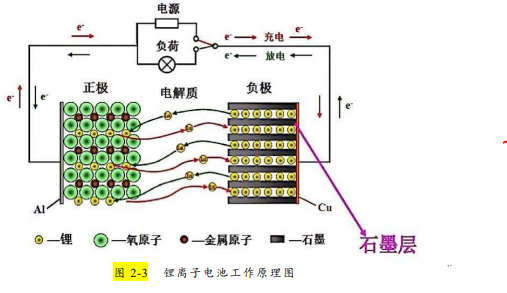
下面以钴酸锂电池(LiCoO2—LixC6)为例来加以详细说明。在钴酸锂锂离子电池中,正极材料为钴酸锂(即氧化钴锂—LiCoO2), 此时的 Co 为+3 价。LiCoO2 可以看做是 Li+嵌入 CoO2(CoO2 中的 Co 为+4 价)所得。负极材料是石墨,注意石墨是层状结构,层与层之间是微弱的范德华力,层内 C 原子通过 sp2 杂化构成平面六边形,层内有未参与杂化的 p 电子可以在其中自由运动。
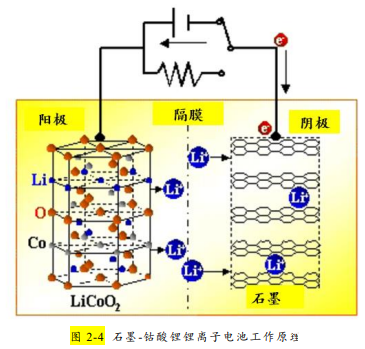
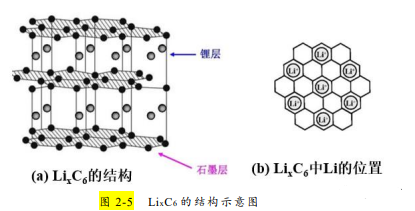
将负极材料石墨与正极材料钴酸锂连接时并没有电流产生。在锂离子电池生产工艺中,锂离子电池生产中很重要的一步、也是在接近电池完成 时的一步重要工序叫做“化成”过程,即给锂离子电池充电的过程,充电后负极才有锂离子存在。充电时,伴随着外电路的电子到达负极,同时有部分如 x 个锂离子(不超过原锂离子的一半)从正极 LiCoO2 中脱嵌,经过电解液和隔膜后插入到石墨层间(如图 2-4 所示),构成了插层化合物 LixC6(如图 2-5 所示)。
这里需要说明的有两点;
①锂离子从正极脱嵌时,并不是正极钴酸锂中所有的锂离子均脱嵌,只能有部分如 x 个锂离子脱嵌, x 不能等于 1,否则钴酸锂的框架结构将会坍塌(看来钴酸锂晶体的大厦 是由 Co、O、Li 三种元素共同支撑的,一旦 Li 全部失去,余下的 Co 与 O 形成 CoO2,那么钴酸锂晶体的大厦将坍塌;如果只失去部分 Li,最多失去一半的 L i,那么这个大厦将由失去 Li 后的 CoO2 和原来遗留下来的 LiCoO2 可以勉力共同支撑)。所以 x 值通常取 0.5,即在电池设计时,如果充满电,此时 x=0.5;
②电池的化成过程即预充电过程中,锂离子移动到负极,外电路等量的电子同时到达负极,而“锂离子+电子”的组合,正 是金属 Li 原子。因此当锂离子伴随着电子同时进入石墨中时,锂离子插入到石墨层间,完全可以看做是金属阳离子 Li+沉浸在自由电子的海洋中, 构成了金属晶体 Li 与石墨的关系,这种关系可以类比于合金,金属锂单质被碳所束缚,LixC6 被称为插层化合物或层间化合物。从专业术语来说,负极材料锂离子的来去叫插入和脱插,正极材料锂离子的来去叫嵌入和脱嵌。
因此锂离子电池的工作原理就是原电池原理。放电时,Li 原子失去电子,电子经外电路、Li+从石墨层间脱插进入电解液,与电子同时移向正极, 在正极得电子的同时,x 个 Li+嵌入到正极 Li1-XCoO2 中形成 LiCoO2。故放电时的负极反应可以写作:LixC6-xe-==xLi++6C;在正极,得电子的元素是高价态金属元素 Co,正极反应为:Li1-XCoO2+xLi++xe-==LiCoO2。放电时的总反应为:LixC6+L i1-xCoO2== L iCoO2+6C。
充电时,锂离子从正极脱嵌, 插入到石墨层中,阳极反应为:LiCoO2-xe-==Li1-XCoO2+xLi+;阴极反应为:6C+xLi++xe-== LixC6。那么也就容易理解,锂离子电池的电容量取决于放 电时能从负极回到正极中的 Li+的数量。能从负极脱插,嵌入到正极的 Li+ 越多,锂离子放电容量越大。
除钴酸锂电池外,其它常见的锂离子电池的正极材料还有磷酸亚铁锂 (LiFePO4)、镍酸锂(LiNiO2)锰酸锂(LiMn2O4)等。它们都是以铝作为集流体(起承载电极、汇集电流的作用)。典型负极材料是石墨,采用铜作为集流体。工作原理与钴酸锂电池相同(如图 2-6 所示)。
如磷酸亚铁锂电池(LiFePO4—LixC6),
放电时的负极反应为:LixC6-xe-==xLi++6C;
正极反应为 :Li1-XFePO4+xLi++xe-==LiFePO4 。
充电时阳极反应 为 :LiFePO4-xe-==Li1-XFePO4+xLi+;
阴极反应为:6C+xLi++xe-== LixC6。


- 全部评论(0)
