有关物质的量计算的知识
时间:2017-04-06 15:03 来源: 作者:陈螯 点击: 次 所属专题: 物质的量计算
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1.有关物质的量的八关系:
①1 mol任何物质都含有阿伏加德罗常数个粒子,即近似为6.02×1023个粒子。
②1 mol任何物质的质量,以克作单位,数值上等于该物质的相对分子质量(或相对原子质量、或相对离子质量等)
③ 对于由分子或直接由原子构成的物质,物质的量相同,所含分子数或原子数相同。
④ 对于相同质量的两种物质而言,摩尔质量与物质的量成反比。即摩尔质量大的,物质的量则小。
![]() =
=![]()
⑤ 对于相同物质的量的两种物质而言,摩尔质量与质量成正比。即摩尔质量大的质量就大。
![]() =
=![]()
⑥ 1 mol分子(或原子)的质量是1个分子(或原子)质量的6.02×1023倍。
⑦ 不同元素的相对原子质量之比等于其摩尔质量之比;不同分子的相对分子质量之比等于其摩尔质量之比。
⑧ 化学反应方程式中,各物质的化学计量数之比既是粒子数之比,也是物质的量之比。(化学反应定律)
相关量纲式:
n =![]() ;n =
;n =![]() 。
。
2.有关气体摩尔体积的八关系:
① 标准状况下,1 mol任何气体所占有的体积都约为22.4 L。
② 同温同压下,同体积的气体具有同数的分子(阿伏加德罗定律)。
③ 有关气体体积的计算中,质量、体积和物质的量的对应单位是“g—L—mol”。
④ 相同体积的两种气体,摩尔质量与质量成正比。即摩尔质量大的,质量大。
![]() =
=![]()
⑤ 相同质量的两种气体,摩尔质量与物质的量成反比。即摩尔质量大的,物质的量小,分子数少。
![]() =
=![]()
⑥ 比较两种气体的轻重,可看密度,最好看相对分子质量。即相对分子质量大的,密度大。
⑦ 混合气体可看成一种纯气体对待(气体相互间不发生反应)。不过平均相对分子质量应按下式计算:
![]() =M1×n1%+M2×n2%+……=M1×V1%+M2×V2%+……
=M1×n1%+M2×n2%+……=M1×V1%+M2×V2%+……
⑧ 化学方程式中,气体物质的化学计量数之比,既是粒子数比,也是物质的量之比,还是相同条件下气体的体积比。(气体反应定律)
有关量纲式:r=![]() ;Vm=
;Vm=![]() 。
。
3.有关物质的量浓度的二关系:
① 同c、同V的溶液中所含溶质的物质的量相等。
② 从一溶液中取出任一体积的溶液,其溶质的物质的量浓度不变,但溶质的物质的量和质量都减少。
(1) 有关量纲式
c=![]() ;m=V×r×w;m=c×V×M
;m=V×r×w;m=c×V×M
(2) 用浓溶液A(用质量分数表示)配制稀溶液B(用物质的量浓度表示)求所需浓溶液的体积VA
cB × VB× M = wA × VA × rA
(mol / L) (L) (g / mol) % (mL) (g / cm3)
(3) 物质的量浓度与溶质的质量分数之间的换算
c × V × M = w × V × r
(mol / L) (L) (g / mol) % (mL) (g / cm3)
c =![]()
令V=1L=1000 mL,则得:c =![]()
(4) 稀释规则:稀释前后溶质的质量和物质的量不变。
m浓×w浓 =m稀×w稀 V浓×r浓×w 浓 =V稀×r稀×w 稀 c浓×V浓 =c稀×V稀
(5) 混合规则:混合前后溶质的质量不变。
m1×w1% +m2×w2% =m3×w3% ,式中,m1+m2 =m3(质量有加和性)
![]() 若告诉混合后溶液的密度,则有体积效应,即V1+V2 1 V3(体积没有加和性),混合后溶液的体积要根据混合溶液的密度来计算。
若告诉混合后溶液的密度,则有体积效应,即V1+V2 1 V3(体积没有加和性),混合后溶液的体积要根据混合溶液的密度来计算。
4.以物质的量为中心的计算体系:
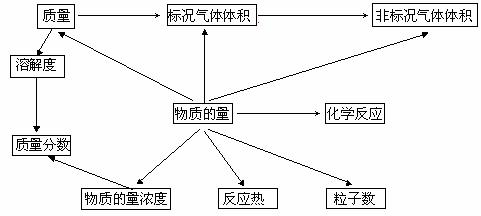
5.建立物质的量的好处在于:
① 它反映了化学反应的实质;
② 它把看不见的、不可量度的粒子数(微观量)和看得见的、可量度的质量或体积(宏观量)联系起来了;
③ 它把气体的体积和分子数联系起来了;
④ 可以建立以物质的量为中心的,联系其它各种物理量的一个完整的化学计算体系;
⑤ 由于化学方程式中各物质的化学计量数之比既是粒子数比,又是物质的量之比,也是相同条件下气体的体积比。这种比值较相应的质量比简单,因此,用物质的量的关系进行计算就比较简捷。
6.阿伏加德罗律的应用
阿伏加德罗定律:同温同压下,同体积的气体具有同数的分子。
在非标准状况下,不能用气体摩尔体积22.4 L / mol进行计算,这时可利用阿氏定律及其有关关系来计算。
由这一定律可知:① 同温同压下,同体积的任何气体含有相同物质的量的分子;② 同温同压下任何混合气体的分子总数与相同状态下的各纯气体的分子数之和相同。并且还可推出气体反应定律:在有气体存在的化学方程式中,气体物质的化学计量数之比,既是分子数之比,物质的量之比,也是相同状态下气体体积比。
与此相关的还有以下几条规律应掌握:
(1) 同温同压下,气体的体积与物质的量成正比。对于一反应体系(包括密闭体系),气体总体积与总的物质的量成正比。即:![]() =
=![]() 。
。
(2) 同温同体积下,气体的压强与物质的量成正比。对于一反应体系(包括密闭体系),气体总的物质的量之比等于压强比。即:![]() =
=![]() 。
。
(3) 同温同压下,同体积的任何气体的质量比等于摩尔质量之比,等于密度之比。即:![]() =
=![]() =
=![]() 。
。
(4) 同温同压下,相同质量的任何气体的体积比等于摩尔质量之反比。即:![]() =
=![]() 。
。
(5) 同温同体积时,等质量的任何气体的压强之比等于摩尔质量的反比。即:![]() =
=![]() 。
。
(6) 当温度相同,物质的量也相同时,气体的体积与压强成反比。即:![]() =
=![]() 。
。
7.气体的相对密度。
气体的相对密度是指两种气体的密度比。
D=![]() =
=![]() =
= ![]() =
= ![]()
(V1 =V2 ) (V1 =V2=22.4 L)
故相对密度可以看作是相同体积时的气体质量比,或是气体的相对分子质量之比。因此,相对密度单位为1,是一个微观量。
利用相对密度可求气态物质的相对分子质量。
Mr1=D×Mr2
若以空气作标准,则为:Mr =29 D空 ,若是氢气作标准,则为:Mr =2![]() 。
。
8.求气态有机物的摩尔质量或相对分子质量
(1) 物质的量定义法:M=![]()
(2) 密度法:M=r×22.4 mol / L
(3) 质量体积法:M=![]() ×22.4 mol / L
×22.4 mol / L
(4) 相对密度法:Mr1=D×Mr2;Mr =29 D空 ,Mr =2![]() 。(微观法)
。(微观法)
9.求混合气体(气体间不发生反应)的平均摩尔质量或平均相对分子质量
(1) 物质的量定义法:![]() =
=![]()
(2) 密度法:![]() =
=![]() ×22.4 mol / L
×22.4 mol / L
(3) 平均量法:混合气体可看成一种气体,不过平均分子量应按下式计算:
![]() =M1×n1%+M2×n2%+……=M1×V1%+M2×V2%+……
=M1×n1%+M2×n2%+……=M1×V1%+M2×V2%+……
10.有关物理量及符号、单位
物理量 | 符号 | 单位 |
物质的量 | n | Mol |
摩尔质量 | M | g / mol |
气体摩尔体积 | Vm | L / mol |
物质的量浓度 | c | mol / L |
质量分数 | w | 1 |
粒子数 | N | 1 |
相对分子质量 | (Mr ) | 1 |
相对原子质量 | (Ar) | 1 |
阿伏加德罗常数 | NA | mol-1 |
气体密度 | ρ | g / L |
固体、液体的密度 | ρ | g / cm3 |

- 全部评论(0)
