分子(离子)的几何构型的判断方法
时间:2022-07-29 10:22 来源:未知 作者:范瑞开 点击:次 所属专题: 分子空间结构判断
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1、确定中心原子价层电子数。它可由下式计算得到:
价层电子对数=(中心原子价电子数+ 配位原子提供电子数-离子所带电荷数)/2
上式中配位原子提供电子数的计算方法是:氢和卤素原子均提供1个价电子;氧和硫原子提供电子为零。因为氧和硫价电子数为6,它与中心原子成键时,往往从中心原子接受2个电子而达到稳定的八隅体结构。
2、根据中心原子的价电子对数,找出电子对间斥力最小的电子排布方式。
静电斥力最小的电子对排布
电子对 | 2 | 3 | 4 | 5 | 6 |
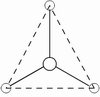
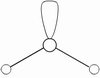
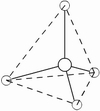
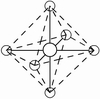
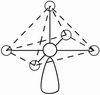
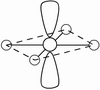
电子对的排布 | 直线 | 平面三角 | 四面体 | 三角双锥 | 八面体 |
3、把配位原子按相应的几何构型排布在中心原子周围,每一对电子连接一个配位原子,剩下的未与配位原子结合的电子对便是孤对电子。含有孤电子对的分子几何构型不同于价电子的排布,孤电子对所处的位置不同,分子空间构型也不同,但孤电子对总是处于斥力最小的位置,除去孤电子对占据的位置后,便是分子的几何构型。
以IF2-为例,用上述步骤预测其空间构型。
(1)中心原子I的价电子数为7,2个配位原子F各提供1个电子。
![]()
(2)查上表知,5对电子是以三角双锥方式排布。
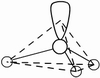
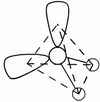
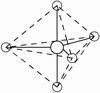
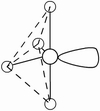
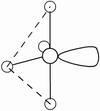
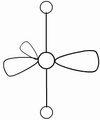
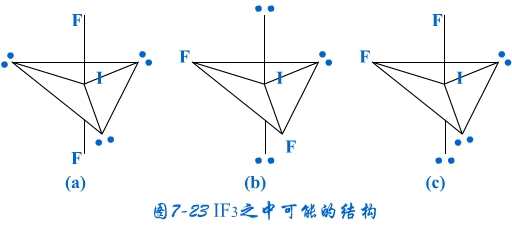
(3)因配位原子F只有2个,所以5对电子中,只有2对为成键电子对,3对为孤对电子。由此可得如图7-23的三种可能情况,选择结构中电子对斥力最小,即夹角最大的那一种结构,则 测定就是IF2-的稳定构型,得到IF2-分子为直线型结构的正确结论。[图7-23(a)]
用上述方法可确定大多数主族元素的化合物分子和复杂离子的构型,现将常见分子构型归纳见下表:
价层电子对数 | 分子结构 | 实际的几何构型 | 实例 | ||
2 | AX2 | 直线形 |
| HgCl2,CO2 | BeCl2 |
3 | AX3 | 平面三角形 |
| BCl3,SO3,CO32-,NO3- | BF3 |
:AX2 | V形(角形) |
| SnCl2,PbCl2,O3,NO2,NO2- | SO2 | |
4 | AX4 | 四面体 |
| CH4,CCl4,SiCl4,NH4+,PO43-,SiO44-,ClO4- | SO42- |
:AX3 | 三角锥 |
| PF3,AsCl3,H3O+,SO32-,ClO3- | NH3 | |
V形(角形) |
| H2S,SF2,SCl2,NH2- | H2O | ||
5 | AX5 | 三角双锥 |
| PF5,AsF5,SOF5 | PCl5 |
:AX4 | 变形四面体 |
| SF4 | TeCl4 | |
T形 |
| BrF4 | ClF4 | ||
直线形 |
| XeF2,IF2- | I3- | ||
6 | AX6 | 八面体 |
| SiF62-,AlF63- | SF6 |
:AX5 | 四方锥 |
| ClF5BrF5 | IF5 | |
平面正方形 |
| XeF4 | ICl4- | ||

- 全部评论(0)