高考化学压强平衡常数Kp及其相关计算
时间:2020-12-17 16:01 来源:未知 作者:化学自习室 点击:次 所属专题: 压强平衡常数
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
在气相反应的化学平衡中,常见考查方式是用浓度c、物质的量n和浓度平衡常数Kc等进行计算,但近几年高考化学逐渐延伸到用气体总压p、分压p(B)和压力平衡常数Kp等进行计算,在高考复习时不能忽视。下面我们一起来了解一下压力平衡常数Kp及其相关计算方法。
一、气体的分压p(B)
1.混合气体中的气体B的分压:
p(B)=p·x(B)
式中x(B)为气体B的体积分数或物质的量分数,p为混合气体在相同温度下的总压强。
2.分压定律:混合气体的总压等于相同温度下各组分气体的分压之和。
p(A) + p(B) + p(C) + p(D) + ··· =p
3.气体的分压之比等于其物质的量之比:
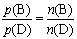
4.某气体的分压p(B)与总压之比等于其物质的量分数:
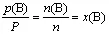
二、压强平衡常数Kp
1.压强平衡常数Kp
一定温度下,气相反应:mA(g) + nB(g)  eC(g) + f D(g) ,达平衡时,气态生成物分压幂之积与气态反应物分压幂之积的比值为一个常数,称为该反应的压力平衡常数,用符号Kp表示,Kp的表达式如下:
eC(g) + f D(g) ,达平衡时,气态生成物分压幂之积与气态反应物分压幂之积的比值为一个常数,称为该反应的压力平衡常数,用符号Kp表示,Kp的表达式如下:
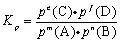
单位: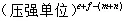 ,Kp只受温度影响。
,Kp只受温度影响。
2.压力平衡常数Kp与总压p、气体体积分数x的关系
一定温度下,刚性密闭容器中发生气相反应:mA(g) + nB(g) eC (g) + fD(g),达到平衡时,令A、B、C、D的分压分别为p(A)、p(B)、p(C)、p(D),A、B、C、D的体积分数为x(A)、x(B)、x(C)、x(D),体系总压p=p(A)+p(B)+p(C)+p(D)。
eC (g) + fD(g),达到平衡时,令A、B、C、D的分压分别为p(A)、p(B)、p(C)、p(D),A、B、C、D的体积分数为x(A)、x(B)、x(C)、x(D),体系总压p=p(A)+p(B)+p(C)+p(D)。
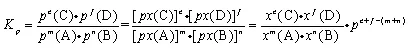
m+n=e+f时,![]() ,
,
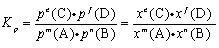
3.浓度平衡常数Kc与压力平衡常数Kp的关系
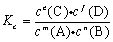
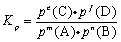
根据理想气体状态方程PV=nRT,可推知:
![]()
三、计算模式—— 三段式
一定温度下,向刚性密闭容器中充入A、B两种气体,发生气相反应:mA(g) + nB(g) eC(g) + fD(g),令A、B起始分压分别为p(A)、p(B),达到平衡后A气体分压的减小值为mx。
eC(g) + fD(g),令A、B起始分压分别为p(A)、p(B),达到平衡后A气体分压的减小值为mx。
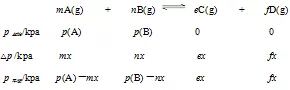

例1.〖2019年全国2卷27(节选)〗某温度下,等物质的量的碘和环戊烯( )在刚性容器内发生反应
)在刚性容器内发生反应 (g)+I2(g)
(g)+I2(g)
 (g)+2HI(g),起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为_________,该反应的平衡常数Kp=_________Pa。
(g)+2HI(g),起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为_________,该反应的平衡常数Kp=_________Pa。
解析:假设反应前碘单质与环戊烯均为nmol,平衡时环戊烯反应了xmol,根据题意可知;
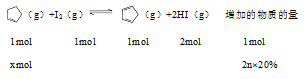
得x=0.4nmol,转化率为0.4n/n×100%=40%;
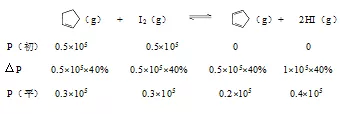
Kp=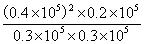 =3.56×104
=3.56×104
例2.〖2018年全国1卷28(节选)〗F. Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应:
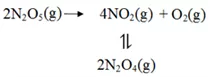
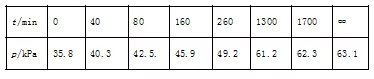
其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示(t=∞时,N2O4(g)完全分解):
①已知:2N2O5(g) 2N2O4(g)+O2(g) ΔH1=−4.4 kJ·mol−1
2N2O4(g)+O2(g) ΔH1=−4.4 kJ·mol−1
2NO2(g) N2O4(g) ΔH2=−55.3 kJ·mol−1
N2O4(g) ΔH2=−55.3 kJ·mol−1
则反应N2O5(g)=2NO2(g)+O2(g)的ΔH =_______ kJ·mol−1。
②研究表明,N2O5(g)分解的反应速率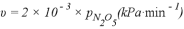 。t=62 min时,测得体系中
。t=62 min时,测得体系中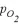 =2.9 kPa,则此时的
=2.9 kPa,则此时的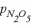 =________ kPa,v=_______kPa·min−1。
=________ kPa,v=_______kPa·min−1。
③若提高反应温度至35℃,则N2O5(g)完全分解后体系压强p∞(35℃)____63.1 kPa(填“大于”“等于”或“小于”),原因是________。
④25℃时N2O4(g) 2NO2(g)反应的平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
2NO2(g)反应的平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
解析:
①已知:
ⅰ、2N2O5(g)=2N2O4(g)+O2(g) ΔH1=-4.4kJ/mol
ⅱ、2NO2(g)=N2O4(g) ΔH2=-55.3kJ/mol
根据盖斯定律可知ⅰ÷2-ⅱ即得到:
N2O5(g)=2NO2(g)+1/2O2(g) ΔH1=+53.1kJ/mol;
②根据方程式可知氧气与消耗五氧化二氮的物质的量之比是1:2,又因为压强之比是物质的量之比,所以消耗五氧化二氮减少的压强是2.9kPa×2=5.8kPa,则此时五氧化二氮的压强是35.8kPa-5.8kPa=30.0kPa,因此此时反应速率v=2.0×10-3×30=6.0×10-2(kPa·min-1);
③由于温度升高,容器容积不变,总压强提高,且二氧化氮二聚为放热反应,温度提高,平衡左移,体系物质的量增加,总压强提高,所以若提高反应温度至35℃,则N2O5(g)完全分解后体系压强p∞(35℃)大于63.1 kPa。
④根据表中数据可知五氧化二氮完全分解时的压强是63.1kPa,根据方程式可知完全分解时最初生成的二氧化氮的压强是35.8kPa×2=71.6kPa,氧气是35.8kPa÷2=17.9kPa,总压强应该是71.6kPa+17.9kPa=89.5kPa,平衡后压强减少了89.5kPa-63.1kPa=26.4kPa,所以根据方程式2NO2(g) N2O4(g)可知平衡时四氧化二氮对应的压强是26.4kPa,二氧化氮对应的压强是71.6kPa-26.4kPa×2=18.8kPa,则反应平衡常数
N2O4(g)可知平衡时四氧化二氮对应的压强是26.4kPa,二氧化氮对应的压强是71.6kPa-26.4kPa×2=18.8kPa,则反应平衡常数
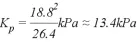

- 全部评论(0)
