大π键知识点总结
时间:2021-01-26 15:10 来源:未知 作者:化学自习室 点击:次 所属专题: 大π键
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
共价键的类型按成键方式可分为σ键和π键。大π键作为π键概念的延伸与拓展,常见于信息题中。
由三个或三个以上的原子形成的π键,在多原子分子或离子中,如有相互平行的p轨道,它们连贯重叠在一起构成一个整体,p电子在多个原子间运动形成π型化学键,这种不局限在两个原子之间的π键称为离域π键或共轭大π键,简称大π键,大π键具有特殊的稳定性。
一、共价键的分类
按电子对是否偏移分为:极性共价键和非极性共价键。
按照共用电子对的数目分为:单键,双键,叁键
按照电子云的重叠方式:σ键和π键
二、定域和离域
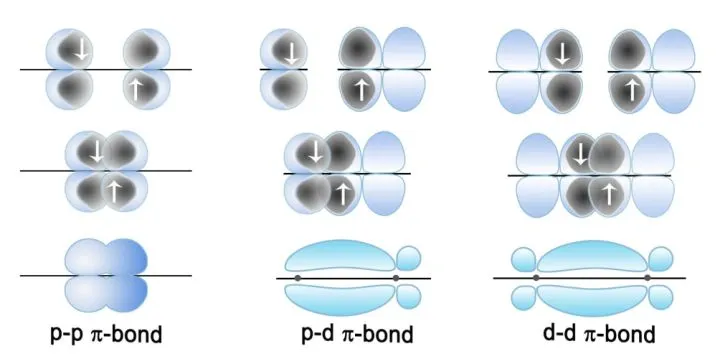
定域键:我们学过的键和π键通常可以被成为定域键,因为这些价电子活动范围局限在两个原子间。
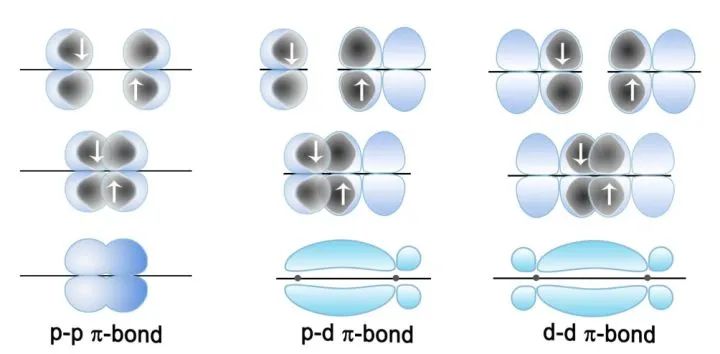
但是有些化合物或离子中的电子不仅仅局限于两个原子之间,而是在参加成键的多个原子形成的分子或离子骨架中运动,这种化学键被称为离域键。如果这些电子来自p轨道,则这些电子所形成的是Π键。
三、什么是离域π键
1、在一个平面形的多原子分子中,如果相邻原子有垂直于分子平面的、对称性一致的、 未参与杂化轨道的原子轨道,那么这些轨道可以相互重叠,形成多中心π键。这种多中心π键又称为“共轭π键”或“离城π键”,简称“大π键”。
2、大π键的形成条件
(1)所有参与离城π键的原子都必须在同一平面内,即连接这些原子的中心原子只能采取sp或sp2杂化;
(2)所有参与离域键的原子都必须提供个成两个相互平行的p轨道;
(3)根据泡利不相容原理,参与离城π键的p轨道上的电子数必须小于2倍的p轨道数。
3、大π键对分子性质有一定的影响。
(1)使分子稳定性增加
苯有离域π键,苯的离域π键表示为π66。它平均分布在六个碳原子上,所以苯分子中每个碳碳键的键长和键能是相等的,既不是单键,也不是双键。使苯环具有特殊的稳定性,这是与烯烃不同的。所以苯的化学性质显现为芳香烃的性质,不易发生加成和氧化反应,易发生取代反应。
再如BF3中π64,因而能稳定单独存在,但与其化学式相似的AlCl3,由于Al的原子半径较大,不容易形成大π键,故气态般以双聚体 Al2Cl6形成存在。
(2)酸碱性改变
苯酚之所以具有弱酸性,是因为苯酚中存在π87,类似地,RCOOH酸性比ROH强,是因为RCOO-中含有π43。
(3)导热导电性
离域π键的电子可在整个离域键的范围内运动,石墨形成很大的离域键,是它能导电的原因。从石墨剥离出的石墨烯,成键情况与石墨相似,构成石画烯的碳原子在2s、2p 和2py轨道上形成杂化轨道,并与相邻的碳原子形成σ键,键角为120°,这种结构特别稳定,且每个碳原子的2pz 轨道上剩余个电子,可以通过电子离域的形式形成大元键。离域的电子在晶体中还可以自由运动,这就使石墨烯具有与石墨等其他纳米材料不具备的特性,例如表面积大、质量轻、导热性能好、能耐高温,可做润滑剂。
4、大π键的符号和表示方法
离域π键符号可用πnm表示。其中m为平行的p轨道数(即参与形成大π键的原子数),n为平行p轨道里的电子数。上述符号可读为“m原子n电子大π键”。
四、离域Π键的例析
sp3杂化时3个方向的np轨道全部用于杂化,没有额外的p轨道垂直平面,无法形成大π键,故只有采用sp2或杂化的sp的原子可以形成大π键。
1、CO2中的大π键
在CO2分子中中心碳原子除了以sp杂化轨道分别与两个氧原子形成两个σ键外,C原子还剩余2个p轨道和2个p电子,它们都与键轴垂直,满足了大π键的形成条件,各组轨道中的电子式在整个分子间运动,而不是局限与某两个原子之间的运动,故在CO2分子中存在大π键。
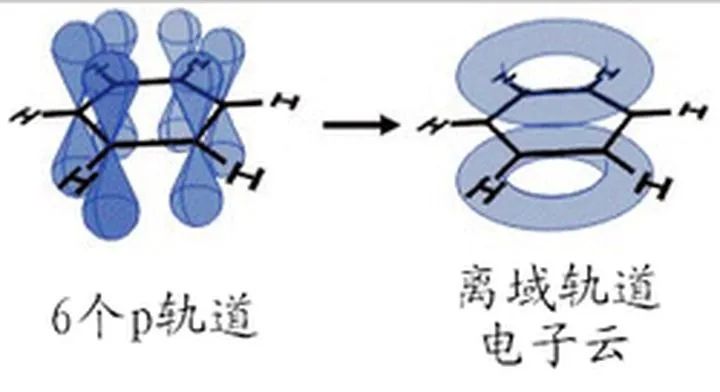
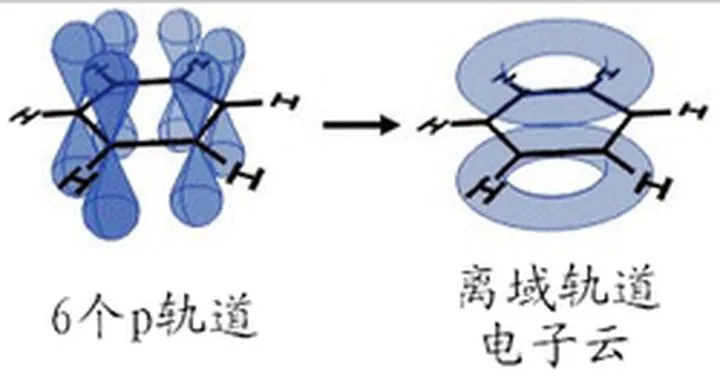
2、苯(C6H6)中的大键
苯分子中碳原子sp2杂化形成σ键后,6个邻近的碳原子各含有垂直于该平面未参与杂化的p轨道,它们相互平行,所以在6个碳原子内形成了多轨道多电子的大π键。
3、SO3分子结构中的大工键
在SO3分子中,中心硫原子采取sp2杂化,1个S原子与3个O原子在同一平面上。未参与p轨道垂直于该平面,端位的O原子与S原子形成σ键,又因为O原子p能级上的3个轨道相互垂直,所以会有一一个轨道垂直于该平面,这样一个S原子与相邻的3个O原子都提供一个相互平行 垂直于该平面的p轨道,所以SO3分子中存在大π键。
4、苯乙烯中的大π键
在苯乙烯分子中的所有邻近C原子均采取sp2杂化,每个碳原子都有未参与杂化的p轨道,它们相互平行且都垂直于杂化轨道所在的平面,所以8个碳原子形成了大π键。
5、石墨中的大π键
石墨是由碳原子构成的六边形平面网状结构,其中C原子以sp2杂化轨道与邻近的3个C原子形成无限的六边形平面网状结构。每个C原子还有1个与碳环平面垂直的未杂化的P轨道,并含有1个未成对电子,因此能够形成大π键。正是由于电子可以在整个六边形平面的网状结构中运动,因此石墨的大π键具有金属键的性质,这就是石墨的沿层的平行方向导电性强的原因。
五、求大π键电子数
所谓“电子式法”,即结合原子的电子式,分析原子在形成σ键后,剩余的价电子,从而确定参与形成大π键的电子数。
下面以吡咯为例,分析其中的大π键。
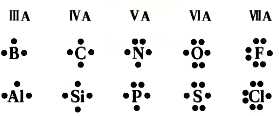
为了方便,这里列出常见原子的电子式:
第1步,找出吡咯分子中所有的σ键,并明确形成这些σ键时,成键原子双方参与成键的价电子:
第2步,统计形成大π键的电子数。若原子在形成σ键后,只余1个单电子,则该电子参与形成大π键,如吡咯中的碳原子;若无单电子,则最多有一对孤对电子参与形成大π键,如吡咯中的氮原子()。
故吡咯分子中参与形成大π键的电子总数为1*4+2=6,即形成的大π键为π65

- 全部评论(0)
(2921014985) 评论 大π键知识点总结:nice!很细节
(2921014985) 评论 大π键知识点总结:nice!很细节
