直击高考电化学题目中的“新概念陷阱”
时间:2021-12-21 11:54 来源:ThInK化学学习社 作者:贺文斌 点击:次 所属专题: 电极判断
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
电化学作为每年高考的必考内容,在电化学反应原理的基础上,不断的创新突破,与科技前沿联系紧密,反应装置上花样翻新。但是基本的解题方法是有共性的。有很多成熟的“套路”可以遵循。
电化学装置,属于氧化还原反应原理的应用,在原电池中,正极发生还原反应,负极发生氧化反应。在电解池中,与直流电源正极相连电极叫阳极,发生氧化反应;与电源负极相连的电极叫阴极,发生还原反应。
学生在处理电化学题目时,往往要通过装置示意图找出原电池的正负极或者电解池的阴阳极,可以通过电流方向,电子流动方向,电解液中离子定向移动的方向,在电极上发生的物质转化等方法确定电极为正负极或阴阳极。确定电极后,大部分问题就迎刃而解了。
判断依据 | 原电池装置 | 电解池装置 | ||
正极 | 负极 | 阳极 | 阴极 | |
电流方向 | 流出 | 流入 | 由直流电源正极流入 | 由阴极流出并流向直流电源负极 |
电子流动 方向 | 流入 | 流出 | 由阳极流出并流向直流电源正极 | 甶直流电源负极流入 |
直流电源 | 与直流电源正极相连 | 与直流电源负极相连 | ||
导电介质 (电解质 溶液)中离子流动方向 | 阳离子定向移动方向 | 阴离子定向移动方向 | 阴离子定向移动方向 | 阳离子定向移动方向 |
物质在电极上的转化 | 某物质有元素化合价降低 | 某物质有元素化合价升高 | 某物质有元素化合价升高 | 某物质有元素化合价降低 |
高考题往往呈现出不易理解的知识背景,给学生带来很多审题上的困难。原因主要是跟学生的知识储备不足有关,但是为了契合电化学知识的考察,选项设置往往相对简单,这种高开低走也成了电化学类型题目一个不可避免的BUG,学生掌握电化学原理,往往还没搞懂题目的新式装置,正确选项却已经选出来了。
那么,新一年的高考出题时,这个BUG可以避免吗?高考题的创新一直都在进行矛与盾的攻防升级,一些独特的创新点在每一年的高考题中都会体现,令人惊艳。
先卖个关子,咱们看看下面这几道高考题,注意选项标红的地方。
例1: (2019年全国Ⅲ卷,13)为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3D−Zn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3D−Zn—NiOOH二次电池,结构如下图所示。电池反应为
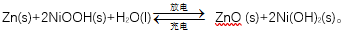
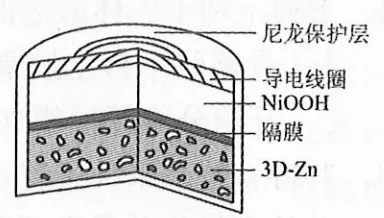

解析:三维多孔海绵状Zn具有较高的表面积,吸附能力强,所沉积的ZnO分散度高,A项正确;充电时相当于是电解池,阳极发生失去电子的氧化反应。根据总反应式可知:阳极是Ni(OH)2 失去电子转化为NiOOH,电极反应式为:Ni(OH)2(s)+OH -(aq)+e-==NiOOH(s)+H2O(l),B项正确; 放电时相当于是原电池,负极发生失去电子的氧化反应。根据总反应式可知:负极反应式为 Zn(s)+2OH-(aq)-2e-==ZnO(s)+H2O(l),C项正确;原电池中阳离子向正极移动,阴离子向负极移动,则放电过程中OH-通过隔膜从正极区移向负极区。D项错误。
例2:(2019年江苏卷20题节选)电解法转化CO2可实现CO2资源化利用。电解CO2制HCOOH的原理示意图如下。
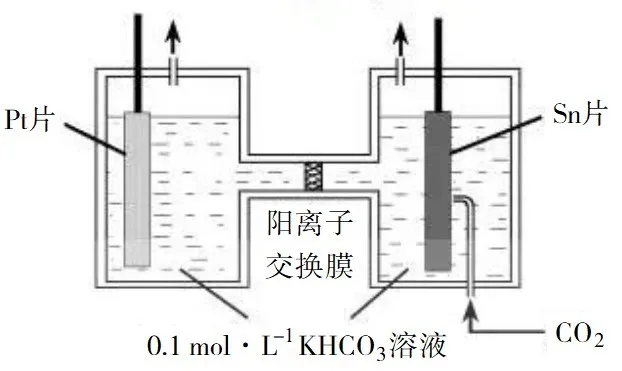
①写出阴极CO2还原为HCOO−的电极反应式: ▲ 。
②电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是 ▲ 。
题目比较常规,没什么特别难的地方。在原电池里,正极区、负极区;在电解池里阳极区、阴极区的概念都很好理解,不就是溶液挨着什么电极就叫什么区嘛。
那我们再看下面这两道高考题,依然注意标红的地方。
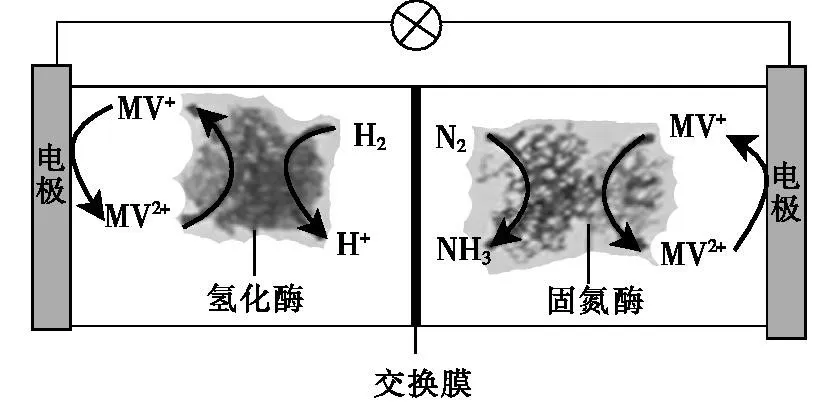
例3:(2019年全国Ⅰ卷,12)利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。下列说法错误的是( )。

例4:(2019年全国Ⅲ卷,28节选)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:
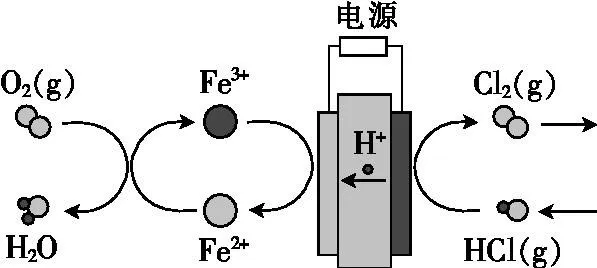
1、负极区发生的反应有 (写反应方程式)。2、电路中转移1 mol电子,需消耗氧气 L(标准状况)。
解析:电解过程中,负极区发生得电子的反应,元素化合价降低,属于还原反应,则图中左侧为负极区。根据图示信息知:负极区发生的反应为Fe3++e-=Fe2+和4Fe2++O2+4H+=4Fe3++2H2O,由O2~4e-知,转移1 mol e-消耗标准状况下O2的体积为1 mol×(1/4)×22.4L/mol=5.6L。
原电池装置里还有阴极区,电解池里出现了负极区?没学过呀,上哪说理去。
这些新概念确实之前没有见到过,增加了题目的理解难度,出现了更多的不确定性。学生根据已有知识进行合理推断,并根据题目出现新概念进行考场上的临场应用也是一种关键的能力,比如近些年出现的Kp计算、电子结合能等概念,这些所谓的新概念并不是刚刚被创造出来的,只不过在高中范围内没有接触,考察学生现学现卖的能力。冷静思考,这些电化学上的新概念也没有那么难懂。下面对相关概念做一个总结。
概念 | 原电池 | 电解池 | ||
电极 | 正极(阴极) | 负极(阳极) | 阴极 | 阳极 |
发生反应 | 还原反应 | 氧化反应 | 还原反应 | 氧化反应 |
溶液区域 | 正极区: 原电池中正极电极附近的溶液 | 负极区: 原电池中负极电极附近的溶液 | 阴极区:电解池中阴极电极附近的溶液 | 阳极区: 电解池中阳极电极附近的溶液 |
阴极区: 原电池中发生还原反应电极附近溶液 | 阳极区: 原电池中发生氧化反应电极附近溶液 | 负极区:电解池中与直流电源负极相连的电极附近的溶液 | 正极区: 电解池中与直流电源正极相连的电极附近的溶液 | |
在电化学装置中,将发生氧化反应的电极称为阳极,发生还原反应的电极是阴极,故在电化学防护中,我们曾学过利用原电池原理的防护方法被称为牺牲阳极的阴极保护法。
小结
电化学题目中的新概念仅仅是高考题创新的一个小点,认清特征,注重临场发挥,才能有效避免陷阱。总之,加强基础知识巩固,提高快速识图读题的阅读能力,才是关键。

- 全部评论(0)
(1938869038) 评论 直击高考电化学题目中的“:阴阳极在电化学中对应的是还原氧化反应的电极是课本上写的啊
