对原子轨道杂化理论的再认识
时间:2021-03-26 08:11 来源:化学原理补正 作者:伍伟夫 点击:次 所属专题: 杂化轨道理论
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
自1931年鲍林在价键法基础上,提出原子杂化轨道理论以来,人们对该理论又有了许多新的看法与新认识。
但这些认识中有相当大的一部分,直到现在也没有在化学教学,尤其是在化学教材中反映出来。
对于化学教师来说,没有必要再复习该理论的一些基本观点。所以,在这里也只是罗列出一些,可以“补充”到不同层次教学中去的,有关原子轨道杂化理论的新看法与新内容。
一、原子轨道杂化的内因
在化学教学中,人们多从某些典型分子的实测构型,从这些化学“事实”来引入杂化轨道概念。
也有从计算或实物演示的角度来说明,形成杂化轨道后可使体系处于能量更低的状态。
其实,指出原子基态轨道在成键时的固有弱点,才算是给出了基态原子轨道需要杂化的根本原因。
作为非金属元素的原子,在相互间通过共价σ键结合,来构成某个分子的骨架时。一般会用到的无非就是如下图一所示的,由薛定谔方程计算出来的,原子最外电子层的ns、np或nd轨道。可以把这些轨道称为“基态原子轨道”。
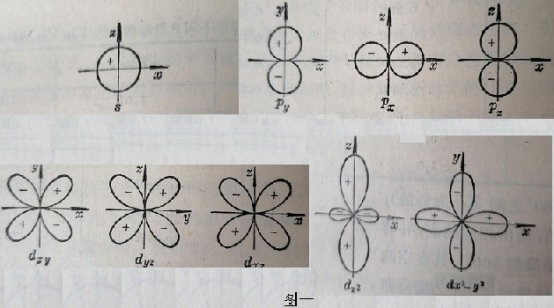
由于ns轨道的空间分布为球形(原子核位于球心),而σ键是关于键轴对称的。所以ns轨道无论与什么轨道去成键,都只能用到其极小的一部分(如下的左、中图阴影部分所示)。而无法满足电子云的“最大重叠条件”。
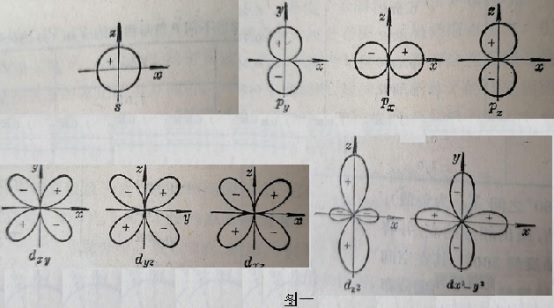
对于同一原子中的三个np轨道(px、py、pz)而言,不但与其他原子的轨道重叠程度有限(如上右图),还要相互间垂直(互成90°)。这就使得这些轨道上的电子(无论是成键电子、还是孤对电子)间,都有相当大的斥力。所以,这种成键情况对于该分子来说,也是非常不稳定的。
至于nd轨道,无论与其他原子的哪个轨道,以“头对头”的方式成键时,不但电子云的重叠部分会很小,且轨道间的夹角都更小(约为90°),相互间有更大的斥力。所以,这样的共价键也都是不稳定的。
由此可以得出一个重要的观点。除了H、He这两个“轻原子”之外,其余“重原子”都不能直接用“基态原子轨道”去直接成键。
为形成稳定的共价键,重原子都需要有,电子云在键轴方向上分布的更集中、电子云相互间的夹角能更大(斥力会更小)的新的原子轨道。
量子力学证明,原子在相互间形成共价键时,其原子轨道确实是会重新“组合”、并用这种经过组合后的“新轨道”来成键。这种由基态原子轨道,经重新组合而得到的新轨道,就是“原子杂化轨道”。
二、杂化轨道的分类
对于主族元素的原子来说,在形成共价分子(或离子)时,其轨道杂化的方式,也就是杂化类型,是相当有限的。
并且,这些杂化类型,与价层电子对互斥理论计算出的“价层电子对数”,如下表那样,相互间能一一对应。
价层电子对数 | 2 | 3 | 4 | 5 | 6 | 7 |
杂化类型 | sp | sp2 | sp3 | sp3d | sp3d2 | sp3d3 |
杂化轨道数目 | 2 | 3 | 4 | 5 | 6 | 7 |
空间构型 | 直线 | 三角 | 四面体 | 三角双锥 | 八面体 | 五角双锥 |
可以说,价层电子对互斥理论的最主要用途,就是能判断出分子中某原子的杂化类型。在二十年多前才被确定下来的这个关系,是原子轨道杂化理论的一大进展[1]。
在有的专著中,给出的原子杂化类型总共有8种。比上述的6种,多了一个直线型的pd杂化,及一个四方锥型的sp3d杂化(与三角双锥的sp3d相比较,其参与杂化的d轨道有所不同)[2]。
应该承认,这两种杂化类型,肯定都有量子力学计算结果的支撑。
但是,对于Pd杂化所列举的XeF2,即便把它看作是一般的sp3d杂化,它也会有“三角双锥”电子云构型。由于3个孤电子对间的斥力,它的两个F配原子也必然要位于该三角双锥的两个相对顶点上,分子仍为直线型。
也就是,pd杂化与普通三角双锥的sp3d杂化间,除了孤电子对的角度分布有差别外,对分子空间构型的判断与结果,不会产生任何影响。而所谓的pd杂化,不但把杂化类型种类給复杂化了,还留下了一个难题。那就是,其未参与杂化的1个S轨道也将被孤对电子占据着,难道它与其它电子对间不会有更大的斥力,从而使分子的稳定性大大降低吗?
另一个特殊的杂化类型是,四方锥型sp3d杂化。且仅以Sb(C6H5)5为其代表。这是一个极为少见、且物质类别所属有些“含糊”的分子。如,它是共价化合物、还是属于配合物?该分子中是否有苯环这种复杂基团间的作用力,导致了“特殊”杂化类型的产生?
最好不要用基本属于价键理论范畴,相对还这么简单的杂化理论,来讨论那些结构过于模糊的化学物质。
在化学教学中,讨论分子空间结构问题,限于上表中的6种杂化类型,一般应该也就够了。
尽管对于第三周期(如Si)及以后各周期的主族元素,其d轨道一定要以某种方式及成分来参与成键。但是,仅用上述6种杂化轨道类型,来讨论共价分子的空间结构,一般还是比较成功的。
对于属于价键理论范畴的原子杂化轨道理论,不应该再提出超出价键理论范畴的要求。
三、杂化轨道的用途
原子杂化轨道在分子构成时的作用只有两个。一个是形成σ键,再一个是被孤电子对占据。
当某原子的杂化轨道类型,用杂化轨道数来表示时。可以有如下的数学关系:
某原子的杂化轨道数=该原子的σ键数+该原子的孤电子对数……(1)
分子中某原子所属的σ键个数,是很容易被确定出来。因为,决定分子骨架的化学键就是σ键。这就使得,单键肯定就是一个σ键,在每个多重键中则必须要有、也只有一个σ键。
这样,从分子的价键结构式、或路易斯电子式,就可以直接地数出,某原子周围的配原子数,即其σ键的数目。对于ABn型的分子式(A为中心原子,B为配原子,n为配原子B的个数),A的σ键数就是n。
在知道“某原子的配原子数”、即其σ键的数目,及其杂化类型的基础上。用式(1),就可以很容易地判断出该原子的“孤电子对数”。
如,就下列分子或离子的中心原子,填写下表:
| 物质 | H2O | SO2 | CO2 | SO42- |
杂化类型(轨道数) | sp3(4) | sp2(3) | sp(2) | sp3(4) |
σ键数 | 2 | 2 | 2 | 4 |
孤电子对数 | 4-2=2 | 3-2=1 | 2-2=0 | 4-4=0 |
电子云空间分布 | 四面体 | 三角形 | 直线型 | 正四面体 |
分子空间构型 | 折线形 | 折线形 | 直线型 | 正四面体 |
注:在讨论“分子空间构型”或“原子空间分布”时,不要再考虑“电子云空间分布”中孤电子对所占有的空间。
关系式(1)的另一个用途则是,用来判断中心原子的杂化类型。即,在已知某原子周围配原子数,及孤电子对数的情况下,就可推断出中心原子的杂化轨道数、即杂化类型。
如,对于H2O与SO2分子。据八电子规则,可写出其如下的路易斯电子式(用不同颜色圆点,对电子出处进行了标记)。
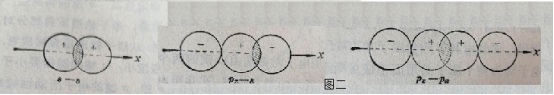
这样,从左图就可以直接看出,O原子有2个σ键(O原子左、右各有一对成键电子),有2个孤电子对(其上、下各有一个孤电子对)。所以,O原子杂化轨道数为“4”。它是sp3杂化。
从右图可看出,S原子有2个σ键(S原子左边是一个σ配键,右边的双键中有一个σ键),还有1个孤电子对(S原子上面的那一对电子)。所以,S原子杂化轨道数为“3”。它采取的是sp2杂化。
四、未参与杂化P轨道一定要参与π键的形成
在6种典型的杂化轨道类型中,只有sp和sp2,这两种杂化类型,还分别剩有2个和1个未参与杂化的P轨道。
人们普遍对于这些未参与杂化的p轨道,没有给与足够的认识。甚至于对其“熟视无睹”。
为强调这个“未参与杂化的p轨道”的重要性,应该突出这样的一个观点。即,“未参与杂化的P轨道一定要参与π键的生成”,且“未参与杂化的p轨道数,就是该原子所具有的π键数”。
可以形象地说,原子轨道在进行杂化时,之所以有时会留下一个或两个p轨道,就是为了要用它来构成同样多数量的π键。
按照价键理论写出的,中心原子为sp2杂化的SO2分子结构式中(上右图),S原子确实就有一个π键。而在CO2分子中,采取sp杂化的C原子,恰好也有两个π键。
当然,这种某原子的一个或两个π键,在满足某些条件(共轭条件)的情况下,还可以转化属于“分子轨道理论”中的“大π键”。这种情况,在本文的后面还要加以讨论。
清楚了这个重要的观点后,人们才会知道,对于那些“未参与杂化的p轨道”,绝不可“视而不见”。
比如,判断出BF3与BeCl2的中心原子分别为sp2与sp杂化,而写出如下的“正三角形”与“直线型”的分子结构式后。一定还要安排好其“未参与杂化的p轨道”的去处。也就是说,在BF3分子中一定要有一个π键,在BeCl2分子中则一定会有两个π键。
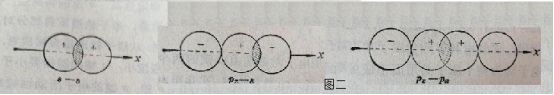
考虑到这两个分子分别与SO3及CO2,互为等电子体(前者有四个重原子二十四个价电子、后者有三个重原子十六个价电子)。应该能很容易地给它们写出如下的电子式(左侧两个),及结构式(右侧两个)。

右侧的这两个分子结构式还在告诉人们,讨论分子结构时,不能只关注中心原子的价电子数,对其成键情况的影响;中心原子的价轨道数,对其成键的影响,有时也是不容忽视的。
五、杂化轨道对键参数的影响
键参数是定量描述分子结构性质的物理量。这种描述是多维,也就是从多个角度、多个方面来进行的。
原子轨道杂化类型对键参数的影响,可分述如下:
1.
键角是描述分子空间构型的一个主要参数。决定键角大小的最主要因素就是,分子中每个原子的杂化类型。杂化类型与键角的关系如下表所示。
杂化类型 | sp | sp2 | sp3 | sp3d | sp3d2 | sp3d3 |
键角 | 180° | 120° | 109.5° | 120°与90° | 90° | 90°与72° |
如果两个原子的杂化类型不同。一般就没有必要再去考虑,孤电子对数目对键角的影响。就更不用考虑,成键原子间电负性不同,对键角的影响。
影响共价键A-B键长的主要因素是,成键原子A与B各自的共价半径。但键长还与它是单键、还是双键有关。也就是,与成键原子的杂化类型有关。所以,对于某些化学键的键长与键能比较,杂化类型往往也起着决定性作用。
如,比较BF3分子与BF4-离子中,B-F键的键长与键能的相对大小。
考虑到BF3分子中的b原子为sp2杂化,分子中一定有π键。也就是其中有B=F双键。
而BF4-离子中的B原子为sp3杂化,分子中不会有π键。也就是其中只有B-F单键。
所以,与BF3分子比较,BF4-离子中B-F键的键长会更大一些。而该键能要更小一些。
3.共价分子的极性
在一般情况下成键原子的种类不同,该共价键就是一个极性键。对于双原子分子,键的极性与分子的极性是统一的。这里就不再赘述。
对于多原子分子来说,则情况会比较复杂。即,哪怕都是由极性键构成,得到的也可能是非极性分子。这取决于分子的对称性,也就是正负电荷的重心、是否能重合,从而把电荷完全抵消掉。
如,采取sp3杂化的CCl4,其C-Cl键是极性键。但是,由于该分子是对称的,所以该分子是非极性分子。
从杂化轨道理论来讨论这个问题,是一个比较好的切入点。即,当中心原子采取等性杂化时,它对应的必然是非极性分子。
对于主族元素ABn型分子来说,当中心原子为sp、sp2与sp3杂化时,只要配原子多于一种,就会使A-B键的键长不等;且,只要有一个孤电子对就会使键角发生变化。这两种情况,都会导致该分子一定不会采取等性杂化,分子就一定有极性。也就是说,只有当中心原子以最高价与一种原子结合时,该分子才是非极性分子。
对于其他3种杂化类型,情况也是这样的。
所以,从分子对称性的角度来看,只要中心原子以最高价、与另一种(只许有一种)原子去结合,那么该分子就一定是非极性分子。该中心原子采取的也一定是“等性杂化”。
如,BF3、CO2、CCl4、CH4、PCl5、SF6,都是非极性分子。
要注意的是,如果中心原子上有孤电子对,它也不见得就是极性分子。还要看孤电子对的分布情况。
如,采取sp3d杂化的XeF2。由于3个孤电子对分布在三角双锥的腰部,F分别位于三角双锥上下的两个顶点。它也属于完全对称的直线型非极性分子。尽管Xe采取的是不等性杂化。
而属于sp3d2杂化的XeF4分子,2个孤电子对分别位于八面体的两个相对顶点上。4个F原子构成了一个正四边形。所以,该分子也是非极性分子。
只有通过杂化轨道的判定来确定分子的空间构型,进而了解分子的对称性,才能够确定出分子是否会有极性。
六、共轭效应对原子杂化类型的影响
由于共轭效应不但能使分子更稳定(内能更小)、键长趋于平均化,还能导致分子性质的改变。所以在有机化学教学中有较多的讨论。
如,苯环中的三个π键由于共轭效应,而构成了一个遍及整个分子的Π66键。而丁二烯中的两个π键由于共轭效应,而构成了一个遍及整个分子的Π44键。
最典型的共轭效应的模型,就是丁二烯分子的如下结构。

按照杂化轨道理论,该分子中的4个C原子都是sp2杂化的,分子中所有原子都位于同一个平面上。既然,1与2、及3与4C原子间可以用其未参与杂化的P轨道,来形成如图的两个π键。相距同样很近的2及3C原子间,不是同样也可以“肩并肩”,即P轨道也发生相互间的重叠,生成约有同样强度的π键吗?
所谓的共轭效应实际上是分子轨道理论要求的,对价键理论的一个扩展。
上面的这种共轭,属于π-π共轭。在无机物中是比较少见的。
在无机物中更为常见的是另一类共轭,即p-π共轭。其形成过程也要更复杂一些,可用下图所示的两个分子来讨论。
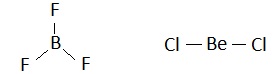
按照杂化轨道理论,左侧的BF3分子中,原本就有一个π键(b与其上方的F原子),而其下方的另两个F原子采取的是sp3杂化(该F原子并没有未参与杂化的p轨道,且另3个sp3杂化轨道都被孤电子对占据着)。
但是,B与F这4个原子都在同一个平面上。只要B下方的两个F原子,能采取sp2杂化,它们就可以各提供出一个p轨道(尽管该轨道上有一孤电子对),而与原有的π键再去“肩并肩”地去共轭,而形成一个Π46键。
也就是说,这两个F原子杂化类型的改变,是共轭效应的要求。共轭效应,可以通过改变分子中某原子的杂化类型,来加以实现。
同样,在上右图的BeCl2分子中。共轭效应也要求,另一端的Cl原子改变杂化类型(成杂化sp),去形成两个Π34键(使它与CO2分子中的成键情况一样)。
从这两个例子不难看出,分子结构中的双键,对其相邻原子的杂化类型,有时也有重要的影响。
还需要指出的是,所谓“分子中双键对相邻原子杂化类型的影响”,并不只是影响到“端基原子”(如F、或非羟基氧O)。双键对非端基原子(如羟基中的O、氨基中的N)的杂化类型,有时也会有影响。
最为典型的是如下的,硼酸晶体中的H3BO3结构单元(见下左图,它与BF3互为等电子体)。
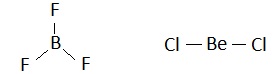
也就是,原来只有结构单元中心的B原子,与其周围的一个羟基中的O原子,采取了sp2杂化(期间有一个普通的π键);而另外2个羟基中的O原子都是sp3杂化的。
由于其中的π键有共轭效应的需求,导致另2个羟基中O原子都也变成了sp2杂化。也就是,所有O原子都采取了sp2杂化。
在上右的H3BO3片层结构图中,所有O原子的sp2杂化,被表现的非常清楚。
共轭效应对羟基中O原子杂化类型的影响,还表现在如下的苯酚结构式中。

以水分子为母体,苯酚是苯基取代了水中的一个H原子,而得到的一个产物。所以,这里的O原子采取的还应该是sp3杂化。
但是,由于苯环中Π66键的共轭效应要求,与苯环直接键连的O原子的杂化类型,要发生变化。为了能形成一个更有效的Π78键,这个O原子实际采取的是sp2杂化。
在苯胺分子中,也会有这样的情况。
总之,由于π键或大π键的共轭效应需求,无论是端基原子还是非端基原子的杂化类型,都有可能受到影响。
七、端基配原子的杂化类型
用价层电子对互斥理论可以很方便地判断各中心原子的杂化类型。但是有些学生还不满足与此。它们还想知道某些配原子的杂化类型。从上面的两例中不难看出,这是一个比较复杂的问题。
对这个问题,要分为两个层次来讨论。
一是,从价键理论的角度来确定。这就需要掌握“环数”的概念[3]。
由于BF3分子的环数是1,所以除了有两个原子为sp2杂化外,其余原子都为sp3杂化。
由于BeCl2分子的环数是2,所以除了有一个原子为sp杂化外,其余原子都为sp2杂化(均如上图所示)。
另一个则是,从分子轨道理论(大π键)的角度来讨论。这就需要掌握“共轭效应”的概念。要考虑到某些原子杂化类型的可能变化(为提供出P轨道)。
不难看出,端基原子杂化类型的判断,无论是其方法、还是过程,都稍微复杂了一些。不应该引入到化学教学中类。
即使是在无机化学教学中,为了回避这个问题,教师也可以简单地解释说:端基重原子的杂化类型不会影响分子的空间构型,通常没有必要去讨论它。在涉及到“大π键”形成时,则可认为它不杂化、或采取sp杂化。这都可以让它提供出足够多的P轨道,而不影响大π键的生成。
参考文献
[1]
[2]
[3]伍伟夫.环数式在无机化学中的应用.新浪博客.“化学原理补正”.

- 全部评论(0)
