能合成氨的电池介绍
时间:2021-03-29 11:00 来源:未知 作者:化学自习室 点击:次 所属专题: 新型化学电源 合成氨
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
背景介绍
在化学教科书里,我们都学过一个哈伯法来合成氨的过程。以氮气和氢气为原料在高温高压下合成氨气,然后合成的氨气通过高压液化移除,使得化学反应平衡偏向正反应方向。要知道这是在二十世纪初期由Fritz Haber和Carl Bosch实现的开发的工艺方法,第一次在工业上大规模合成氨。(Fritz Haber因此获得了1918年的诺贝尔化学奖)一百多年过去了,现在合成氨的工业仍然是基于这一个过程。有人估计由哈伯过程生产的氨产生的氮肥服务于农业,养活了近地球三分之一的人口。当然,另一个事实就是合成氨工业消耗的能源占地球总总耗能的1%,也贡献了地球3%的二氧化碳的排放量。
当小编再次仔细揣摩这个放热的氧化还原反应的时候,
N2 + 3 H2 → 2 NH3 (ΔH° =−91.8 kJ) => (ΔH° = −45.8 kJ·mol−1),
突然想起了化学老师的一句话:凡是能发生氧化还原反应的,理论上都可以来构成电池。
研究概述
在Angew. Chem. Int.Ed.上最近上线的这篇VIP文章中,犹他大学的Minteer教授通过构筑H2/N2生物燃料电池,真的就是以氮气和氢气为原料,在合成氨的同时还能获得电能。
在生物界,固氮酶是唯一一种能还原氮气制备氨气的生物催化剂。作者通过构筑生物燃料电池,以氢化酶为负极催化剂,固氮酶为正极催化剂,质子交换膜为隔膜,在室温条件下即实现了氨的合成同时还能提供电能。
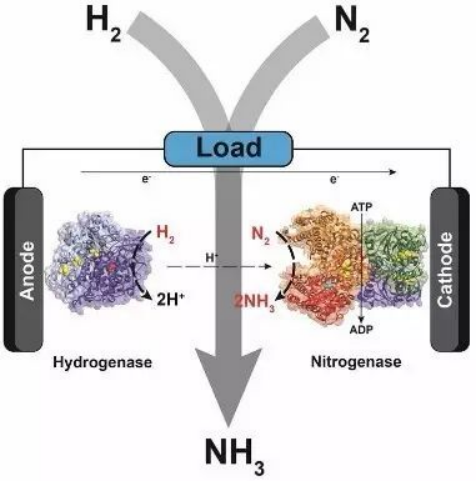
图1. 以氢化酶作为负极负极催化剂(氢气被氧化),固氮酶作为正极催化剂(氮气被还原),使用质子交换膜,实现提供电能的同时能够产氨气 (图片来自chemistry world)
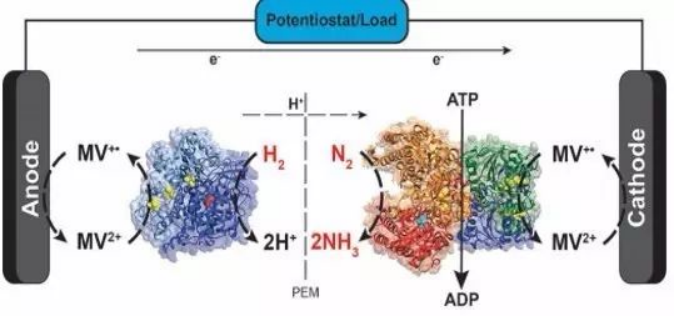
一般的生物燃料电池使用能发生氧化还原反应的酶作为生物电催化剂作为电池的正负极。这种电池一般在比较温和的环境中(常温,常压,且中性环境;防止酶变性)。在这种条件下,酶和电极之间的电子转移非常缓慢,一般使用能发生可逆的氧化还原分子来加速电子转移。之前的论文报道的电子转移中间体都需要很负的电位来还原,以实现电荷的传递。在这篇论文中作者通过使用N,N′-dimethyl-4,4′-bipyridinium(MV)来传递电子给固氮酶,N2能够在固氮酶的作用下被还原生产NH3。
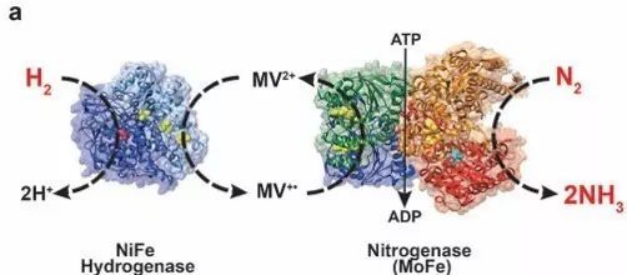
图2 氢化酶催化氧化氢分子,转移的电子用来还原MV2+,生成MV+; MV+将电子传递给固氮酶催化剂用来还原氮气分子。
作者首先分别验证MV2+和氢化酶共同作用的时候的的氧化能力,以及MV+和固氮酶共同作用的还原能力。在优化好固氮酶和MV+的比例后,作者分别探究了其对N2(产物为:NH3)以及C2H2 (产物为C2H4)的还原过程,能分别检测到1018±11 nmol C2H4 和 588±76 nmol NH min-1g-1 (注:为每克固氮酶 );当把MV+移除或者使用MV2+替代,都无法还原N2和C2H2;这表明MV+确实能够有效的传递电子给固氮酶。使用同样的方法作者也证明了MV2+和氢化酶共同作用的时候能有效的氧化氢气分子。
构成电池时,中间使用质子交换膜隔开,允许质子通过,而MV2+/ MV+负责在电极和催化剂直接传递电荷,从而实现回路。

- 全部评论(0)
