关于反应自发性的问题讨论
时间:2022-02-13 11:11 来源:未知 作者:王笃年 点击:次 所属专题: 自发反应
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
化学反应的自发性是一个比较抽象的概念,对于 初学者来说,很难理解研究反应自发性的意义.所以, 教科书里一般只是按照人们认识化学反应是否容易 发生的历史顺序,先后提出了“焓变(ΔH)判据——放热的反应比较容易发生”,“熵变(ΔS)判据——体系混 乱度增大的反应比较容易发生",“吉布斯自由能(ΔG) 判据体系自由能降低的过程属于自发反应过程”,但并未做更进一步深入细致的讨论。
1、自发反应有的需要活化能(先期需要加热),非自发反应若给以能量也能够发生,那么,研究反应自发性的意义何在?
首先对该问题具体解读如下:
合成氨反应,N2(g)+3H2(g) 2NH3(g) ΔH = -92 kJ•mol-1, 这是一个放热、自发的反应,却需要“高温、高压、催化剂”的反应条件;而水的分解反应2H2O(l) = 2H2(g)+O2(g) ΔH = +576 kJ •mol-1,虽然属于非自发反应,若给以能量(如通电电解,或者加热到极高温度),也可以发生。这样一来,看上去似乎研究反应自发性的意义不大了。
2NH3(g) ΔH = -92 kJ•mol-1, 这是一个放热、自发的反应,却需要“高温、高压、催化剂”的反应条件;而水的分解反应2H2O(l) = 2H2(g)+O2(g) ΔH = +576 kJ •mol-1,虽然属于非自发反应,若给以能量(如通电电解,或者加热到极高温度),也可以发生。这样一来,看上去似乎研究反应自发性的意义不大了。
其实不然。
首先,研究化学反应,并非只是研究物质转化,很多时候我们需要利用化学反应释放或储存(吸收)能量,比如,现在要设计1个电池,并不能简单地选择一 个氧化还原反应就用,还得看该反应能不能释放自由 能,即看其ΔG是否为负,以及负的程度有多大,因为我们需要能量,需要电池具有一定的电压(电动势), 而ΔG与电池电动势之间存在如下计量关系ΔG = -n FE,式中 n 是该反应转移的电子数;F 是法拉第常数,即1 mol 电子所带的电荷量为96500 C;E 是该 电池的电动势。
正常情况下,很少会有人去选择一个非自发的氧化还原反应设计电池,因为它的发生需要外界提供能量,而不可能通过反应向外界提供任何形式的能量。
其次,即使通过外界提供能量可以使某些非自发的反应在一定条件下得以发生,该反应是否具有实际的应用价值,还得看反应平衡常数K的大小,K和G 也存在如下定量关系:ΔG = —RTlnK式中,R是气体常数,T为国际温标,K则是反应的平衡常数。如果 ΔG非常大(正值),则K极小,这样的反应即使通过外界提供能量得以发生,达到平衡时目标产物在平衡混合体系内的含量也极低,很难分离,实用性不大。这就是为什么空气中存在大量N2,O2,而人们很少考虑 利用 N2+O2=2NO 反应固氮的原因之一(该反应的平衡常数极小,约在10-30量级)。
2、催化剂能不能让非自发反应变为自发反应?
请参考图1:
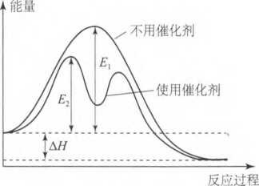
图1
使用催化剂,改变了反应的路径,降低了反应的活化能(E1 → E2),但并没有改变反应物、生成物的能量,故反应的焓变没有变化。根据与ΔG的 关系ΔH = ΔG +TΔS可知,在一定温度下,也不可能发生变化,故使用催化剂只能够改变反应速率, 并不能改变反应的自发性。
进一步想,根据ΔG=-RTlnK可知,ΔG不变, 则K亦不变,所以说催化剂可以改变反应速率,但不能改变平衡状态。
3、常温下非自发反应一定不会发生吗?可逆反应能够在同一条件下向正、逆2个方向进行,如何理解其自发性?
其实这是同一个问题的2种问法,H+ + OH-=H2O是自发反应,而其逆过程 H2O H++OH-在常温下也发生了,只是水的电离非常微弱而已。所以,“自发”、“非自发”与实际“发生” “不发生”不是对应的关系。根据ΔG= -RTlnK关系 知,自发反应ΔG<0,对应的K>1。那些K<1的反应则属于非自发反应,它们并非不能发生,只是反应进行的程度弱而已。
H++OH-在常温下也发生了,只是水的电离非常微弱而已。所以,“自发”、“非自发”与实际“发生” “不发生”不是对应的关系。根据ΔG= -RTlnK关系 知,自发反应ΔG<0,对应的K>1。那些K<1的反应则属于非自发反应,它们并非不能发生,只是反应进行的程度弱而已。

- 全部评论(0)
