有关硝酸的三个疑难问题
时间:2022-03-25 09:54 来源:未知 作者:岳文虹 点击:次 所属专题: 硝酸
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、Cu 与浓 HNO3、稀 HNO3反应后颜色为什么不同?
不同浓度的硝酸与铜发生如下反应:Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O;3Cu+8HNO3(稀)==3Cu(NO3)2+2NO↑+4H2O。理论上二者反应后留在溶液中的产物相同,均为 Cu(NO3)2 溶液,但实验表 明,两溶液中的颜色明显不同,浓 HNO3 反应后的溶液呈绿色,稀 HNO3 反应后 的溶液呈蓝色(如图所示)。为什么会有这样的差异呢?
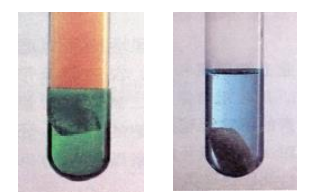
左图为浓 HNO3和铜、右图为稀 HNO3和铜
经对比分析,猜想现象不同的原因可能是:
①铜离子浓度不同;
②NO2 的影 响。
为验证上述推测的合理性,采用如下实验方案进行探究:
⑴ 加热浓 HNO3 与 Cu 反应后的溶液,使 NO2 逸出,观察颜色变化。现象:溶液颜色绿色变浅,逐渐变为蓝色。
⑵ 向稀 HNO3 与 Cu 反应后的溶液中通入 NO2,观察颜色变化。现象:溶液颜色逐渐由蓝色变为绿色。
⑶ 配制饱和的 Cu(NO3)2 溶液(如图 1-58 所示),然后加水稀释,观察颜色变化。

现象:饱和 Cu(NO3)2溶液为深蓝色,稀释后的 Cu(NO3)2 溶液为浅蓝色。
综上可知,不同浓度的 HNO3 与 Cu 反应后颜色不同并不是铜离子浓度差异造成的,而是与 NO2 的溶解有关。稀 HNO3 与 Cu 反应得到的溶液是蓝色的,这 是 [Cu(H2O)6 ]2+配离子的颜色;而当浓 HNO3 与 Cu 反应时,由于生成了大量 NO2, 溶解在溶液中呈黄色,根据光学原理可知,黄色和蓝色的混合色呈绿色,所以此 时溶液是绿色的。
二、浓硝酸分解条件是什么?
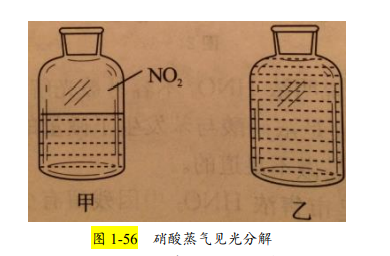
2019人教版、鲁科版、苏教版的中学教材中均有“硝酸或浓硝酸见光或受热 会分解产生 NO2”的叙述。但研究者发现,硝酸对热比较稳定,特别是在常温下很稳定。这是因为,硝酸的分解温度为 256℃,沸点只有 121.8℃。因此,“硝酸 或浓硝酸受热分解产生 NO2”的结论是不成立的。事实上,硝酸只有受热变为硝 酸蒸气后才会见光分解,产生红棕色的 NO2。
证实上述结论可采用如图 1-56 的 实验方法。在甲、乙两个试剂瓶中分别装有半满、全满的浓硝酸。然后将其放在 日光下暴晒,结果发现:甲试剂瓶中几分钟左右就可以看到试剂瓶上方有红棕色 气体产生,且红棕色越来越明显,近 1 小时后试剂瓶中的液体的颜色已与溴水相近;而装满浓硝酸的乙试剂瓶中一直观察不到明显的现象。这充分说明了“硝酸 25 受热分解”的说法是不严谨的,正确的说法应是“硝酸受热变为硝酸蒸气后见光易 分解”。
三、NO3-在酸性条件下一定能氧化 Fe2+吗?
首先,我们来比较一下 2010 年和 2011 年的两道江苏高考试题及解析:
(2010 年江苏卷)6. 常温下,下列各组离子在指定溶液中能大量共存的是:
A.pH=1 的溶液中:Fe2+、NO3-、SO42-、Na+
解析:因 pH=1 的溶液有大量 H+,而 H+、Fe2+、NO3-会发生氧化还原反应, 则不能大量共存,故 A错误。
(2011 年江苏卷)4. 常温下,下列各组离子在指定溶液中一定能大量共存 的是:
A.1.0mol·L﹣1 的 KNO3 溶液:H+、Fe2+、Cl﹣、SO42-
解析:在酸性条件下,NO3-具有强氧化性,Fe2+具有还原性,二者因发生氧化还原反应而不能大量共存,故A 错误。
实际上,这两道题的解析都是存在问题的,即:NO3-在酸性条件下一定能氧 化 Fe2+吗?我们可将表 1-10 中的试剂等体积混合进行实验验证:
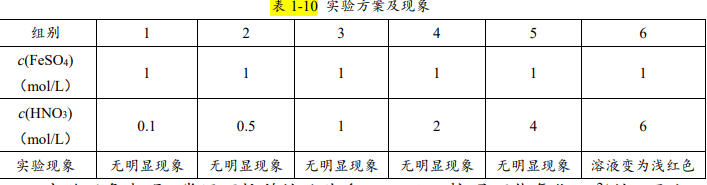
实验现象表明,常温下较稀的硝酸(<2 mol·L﹣1)是不能氧化 Fe2+的。因此,常温下,Fe2+、NO3-、H+一定能大量共存的说法是不正确的,但有可能大量共 存的说法是正确的。所以,2010 年江苏卷 6 题为一错题,即:常温下,pH=1 的 溶液中,Fe2+、NO3-、SO42-、Na+是可以大量共存的。

- 全部评论(0)
