铵盐为什么易溶于水?
时间:2022-08-03 16:13 来源:未知 作者:化学自习室 点击:次 所属专题: 铵盐
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
铵盐都是离子化合物。离子化合物溶于水经历两个基本过程,一是吸收能量离子键的断裂,二是离子的水合放热过程。如果离子键较弱,则容易被破坏,一般也就易溶于水;或者离子的水合过程放热较大,也能帮助第一步的离子键的断裂,提高其溶解度。

(绝大部分铵盐溶于水,都是吸热的)
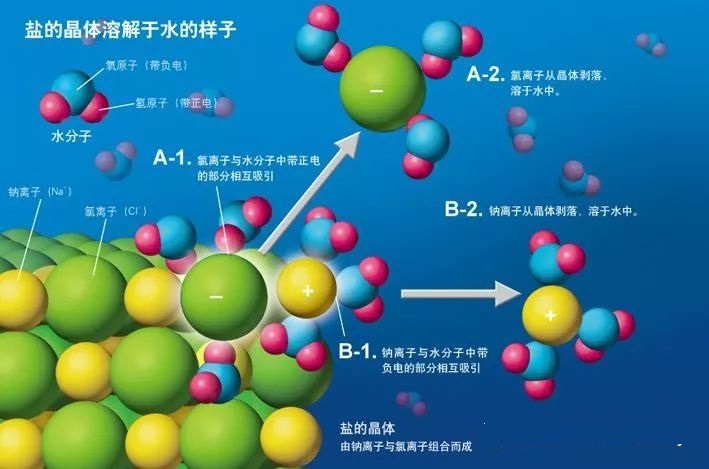
(离子键的破坏及离子的水合过程)
高中阶段一般只考虑第一阶段的影响因素,即离子键的强弱受离子的半径和离子所带电荷的影响。离子半径越小和离子所带电荷越多,则离子键越强。那么为什么呢?
化学学科中有一软硬酸碱理论简称HSAB(Hard-Sft-Acid-Base)理论,是一种尝试解释酸碱反应及其性质的现代理论。其最重要的作用在于对配合物稳定性的判别和其反应机理的解释。软硬酸碱理论的基础是酸碱电子论,即以电子对得失作为判定酸、碱的标准。而离子化合物中的阴、阳离子即是酸碱电子论中的碱和酸。
在软硬酸碱理论中,酸、碱被分别归为“硬”、“软”两种。“硬”是指那些具有较高电荷密度、较小半径的粒子(离子、原子、分子),即电荷密度与粒子半径的比值较大。“软”是指那些具有较低电荷密度和较大半径的粒子。“硬”粒子的极化性较低,但极性较大;“软”粒子的极化性较高,但极性较小。
中心主旨是:在其他因素相同时,“软”的酸与“软”的碱反应较快速,形成较强键结;而“硬”的酸与“硬”的碱反应较快速,形成较强键结。即所谓的“硬亲硬,软亲软”生成的化合物较稳定。
铵根离子的电荷少,离子半径较大,则与半径较小的酸根阴离子结合能力较弱,即离子键弱,在水中溶解时容易断裂,有利于其溶解。另一方面,铵根离子对水分子的极化能力弱,水合作用则弱,放热很少,对第一步离子键的破坏帮助不大。
当然,单铵根离子碰上离子半径较大的酸根离子时,就不同了,如:高氯酸根离子。NH4ClO4的溶解度就不是很大,两者半径都较大,属于“软亲软”规则。还有在《实验化学》中往AlCl3溶液中滴加NaF,再滴加NH3H2O溶液,溶液中往往会出现浑浊,就是因为产生了微溶的(NH4)3AlF6等物质。
沉淀溶解平衡中一则经典实验:AgF--AgCl--AgI--Ag2S。可用Ksp解释,也可以用软硬酸碱理论解释。Ag+半径较大,属于“软酸”,而F—属于“硬碱”,随着阴离子半径增大,碱越来越“软”,作用力就越来越强,则溶解度越小。
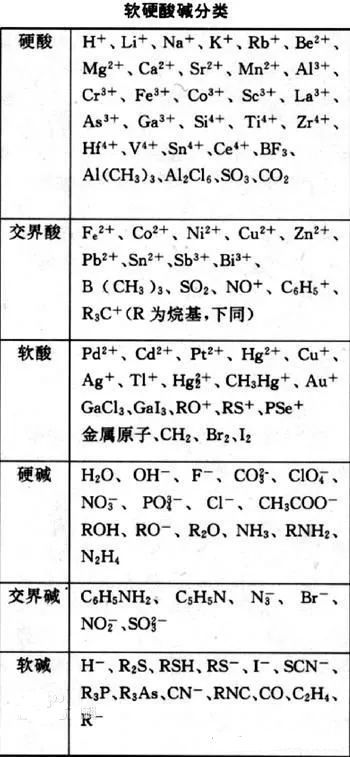
那么有没有不符合软硬酸碱理论的呢?肯定有啊!如软碱CN-和硬酸Fe3+和软酸Ag+都很容易反应。

- 全部评论(0)
