键长、键能、键角简介
时间:2012-12-03 11:24 来源:未知 作者:张超鹏 点击: 次 所属专题: 键能 键角 键长
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
键长:成键原子核间的距离
杂化类型对键长的影响:对于C—C键键长,有SP3> SP2 > SP
共价键键长数据 (nm)
化合物 | C-C | C=C | C≡C | C-H |
CH3-CH3 | 0.153 | 0.109 | ||
CH2=CH2 | 0.134 | 0.109 | ||
CH≡CH | 0.121 | 0.106 | ||
CH3-CH=CH-CH3 | 0.154 | 0.134 | ||
CH3-C≡C-CH3 | 0.147 | 0.120 | 0.109 |
键能(Bond Energy):
— 1mol 双原子分子(气态)离解成原子(气态)所吸收的能量。
— 多原子分子(气态)完全离解成原子(气态) 所吸收的能量即为该分子所有共价键键能总和。
— 对于多原子分子键能为平均值。
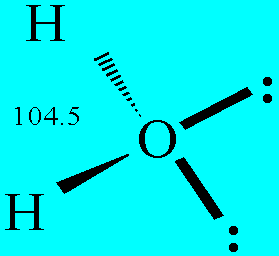
键角(Bond Angle):
分子中同一个原子所形成的两个共价键间的夹角。H2O的键角如下
(责任编辑:化学自习室)

说点什么吧
- 全部评论(0)
还没有评论,快来抢沙发吧!
