金属冶炼的方法
时间:2016-01-28 20:58 来源:未知 作者:万胜 点击:次 所属专题: 金属冶炼
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
(1)热分解法:
有些不活泼金属可以用简单加热的方法得到,大多数氧化物直到1273K仍是稳定的,但是在金属活动性顺序表中,位于Cu后面的金属氧化物受热易分解。如:
2HgO ![]() 2Hg+O2↑ 2Ag2O
2Hg+O2↑ 2Ag2O![]() 4Ag+O2↑
4Ag+O2↑
(2)热还原法:
多数金属的冶炼过程属于热还原法。常用的还原剂为焦炭、一氧化碳、氢气和活泼金属等,适合于金属活动性介于Zn~Cu之间的大多数金属的冶炼,例如:

①用碳作还原剂冶炼金属
用CO作还原剂来冶炼金属,制取CO的原料通常是焦炭,C也可以直接从矿石中把金属还原出来。例如:从锡石(SnO2)或赤铜矿(Cu2O)中制取锡或铜。
![]()
如果矿石中主要成分是碳酸盐,因为一般金属的碳酸盐受热时都能分解为氧化物,再用碳还原。
![]()
②用活泼金属作还原剂冶炼金属
除铝热反应外,还可用金属Mg作还原剂,例:2Mg+TiCl4 2MgCl2+Ti。
2MgCl2+Ti。
用金属Na作还原剂,例如:Na+KCl NaCl+K↑。此氧化还原反应为可逆过程,尽管还原性Na<K,但两者相差不大(因两者在金属活动性顺序表中处于相邻位置)。但由于Na的沸点高于K,控制一定温度范围,可使金属K以蒸气状态逸出,离开平衡体系,根据平衡移动原理,反应向正方向进行。
NaCl+K↑。此氧化还原反应为可逆过程,尽管还原性Na<K,但两者相差不大(因两者在金属活动性顺序表中处于相邻位置)。但由于Na的沸点高于K,控制一定温度范围,可使金属K以蒸气状态逸出,离开平衡体系,根据平衡移动原理,反应向正方向进行。
(3)电解法
金属活动性很强的金属(K、Ca、Na、Mg、Al等)的离子得电子的能力很弱,很难被还原剂还原。通常用电解其熔融盐或熔融氧化物的方法来制取活泼金属。
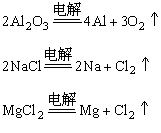
常见金属的冶炼方法如下表
方法名称 | 主要化学反应原理(举例) | 主要特点 | |
还原剂法 | CO作还原剂 | C | 炼得的金属为合金。生产成本较低。金属的活泼性不强。 |
H2作还原剂 | C | 金属跟水在高温下也不易反应。炼得的金属纯度高。生产成本较高。 | |
Na、Mg、Al、Ca | 2Mg+TiCl4 | 被冶炼的金属活泼性不强,熔点高。炼得的金属纯度较高。生产成本高。 | |
电解法 | 普通电解 | 2NaCl(1) | 被冶炼的金属活泼性强。炼得金属纯度高。耗电量大,生产成本较高。 |
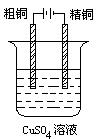
电解精炼 |
| 炼得高纯度的铜。耗电量大,生产成本较高。 | |
热分解法 | HgS+O2 | 适合冶炼金属活动性较差的金属 | |
淘取法 |
| 适合以游离态存在的密度较大的金属。所得金属纯度不高,需精炼。 | |

- 全部评论(0)