化学方程式中箭号应如何运用呢?
时间:2016-01-17 14:23 来源:安徽省肥东县第二中学 作者:孙远征 点击:次 所属专题: 化学反应方程式
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
在全日制十年制初中化学课本53页上指出:“如果生成物中有沉淀或者气体产生,一般应该用↑号或者↓号表示出来”。并举例:
2KClO3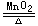 2KCl + 3O2↑,CuSO4 + 2NaOH
2KCl + 3O2↑,CuSO4 + 2NaOH
一、向上箭号的运用
1、举例
分析生成物是气体,与反应物状态不同,从溶液里生成,在气体的化学式的右边应用向上的箭号来表示。
2.举例 CaO +CO2↑,NH4HCO3
CaO +CO2↑,NH4HCO3 NH3↑+ CO2↑+ H2O,2NaNO3
NH3↑+ CO2↑+ H2O,2NaNO3 2NaNO2 +O2↑
2NaNO2 +O2↑
分析
3、举例4FeS2+11O2== 2Fe2O3+8SO2,2SO2+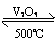 2SO3
2SO3
分析
4.举例Na2S2O3+H2SO4(稀)
分析
5、举例NaHS + H2O NaCl + NaHS,NaHCO3+H2O
NaCl + NaHS,NaHCO3+H2O NaOH + H2CO3,Al2S3+ 6H2O == 2Al(OH)3↓+ 3H2S ↑
NaOH + H2CO3,Al2S3+ 6H2O == 2Al(OH)3↓+ 3H2S ↑
分析
二、向下箭号的运用
1.举例CuSO4+Na2S ==
2.举例S + Fe FeS,O2
FeS,O2 2H2O + 2S,SO2+2H2S == 2H2O + 3S
2H2O + 2S,SO2+2H2S == 2H2O + 3S
3、举例制备澄清石灰水:CaO + H2O == Ca(OH)2,CaCl2+2NaOH == Ca(OH)2↓ + MgCO3↓+ CO2↑ + H2O
MgCO3↓+ CO2↑ + H2O
分析生成物是微溶物质,应以实验事实作为依据。当微溶物质处于溶解状态时,不要用向下的箭号表示;如微溶物质在溶液里是以沉淀析出的,应该用箭号来表示。
4、举例AgNO3+KI ==
分析: 生成的难溶物质在溶液里形成了肢体;成为一种稳定的分散体系,不要用向下韵号。
5、举例FeCl3+3H2O Fe(OH)3+3 HCl,SnCl2 + 2H2O
Fe(OH)3+3 HCl,SnCl2 + 2H2O Sn(OH)Cl + 2HCl,2Al3+
Sn(OH)Cl + 2HCl,2Al3+
分析: 水解不能进行到底的盐溶液,无沉淀生成,不用向下箭号。能水解到底的盐溶液,有沉淀生成,要用向下箭号。

- 全部评论(0)
