氯气、氢氧化钠溶液能形成原电池吗
时间:2015-05-27 20:53 来源: 作者:龙立球 点击:次 所属专题: 氯气 原电池条件
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
◇形成原电池的前提有四个
条件1:在体系中存在一个自发的放热的氧化还原反应。
条件2:存在电解质溶液或者熔融的电解质
条件3:组成一个闭合回路
条件4:两个电极(大部分情况这两个电极的材料应该是不相同的)
◇关于氢气和氧气燃料电池
1、氢气和氧气反应是一个自发的并发热的氧化还原反应,符合条件1
2、我们可以使用氢氧化钠溶液做电解质,稀硫酸也可以,符合条件2
3、完全可以组成一个闭合回路,符合条件3
4、使用两个石墨电极,符合条件4
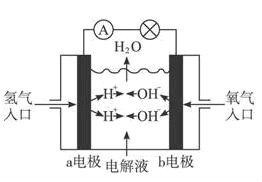
◇氢氧燃料电池的经典实验如下图所示,完全可以达到实验目的
若电解质溶液是碱、盐溶液
则负极反应式为:2H2 + 4OH--4e-== 4H2O正极为:O2+2H2O + 4e-== 4OH-
若电解质溶液是酸溶液
则负极反应式为:2H2-4e-=4H+,正极为:O2+4e-+4H+=2H2O
依据以上的情景,那氯气和氢氧化钠溶液是否可以形成原电池呢?
【理论分析】氯气在整个体系中,应该既要得到电子又要失去电子才可以,很清楚:
假如氯气得到电子,其电极方程式为Cl2+2e-=2Cl-,为电源的正极;
假如氯气失去电子,其电极方程式为Cl2-2e-+4OH-=2ClO-+2H2O;
总反应为Cl2+2OH-= Cl-+ClO-+H2O,完全符合题意。
【设计实验一】
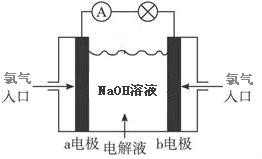
很明显,这一定不可能形成原电池,道理很简单,两个电极附近情况完全相同,氯气得到电子和失去电子的趋势一模一样,不可能在闭合回路中形成电流。(电极电位相同)
【设计实验二】
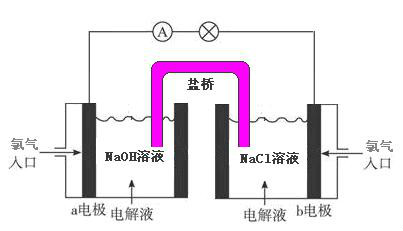
在这个实验设计中,氯气所处的环境已经不相同,从理论上讲可以做到A电极处氯气可以失去电子,而B电极附近的氯气可以得到电子。
【理论依据】
Cl2(g) + 2e-= 2Cl-电极电位为1.3595
Cl2-2e-+4OH-=2ClO-+2H2O电极点位为?(暂时查不到)
【实验验证】
1、关键是需要能充满氯气的石墨电极;
2、该实验的电流一定非常小,需要灵敏电流计。

- 全部评论(0)
