氢氧化铝的两性解读(三元碱 一元酸)
时间:2015-12-28 09:35 来源:未知 作者:张超鹏 点击:次 所属专题: 氢氧化铝
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一.三元碱一元酸
我们已经知道Al(OH)3是酸碱两性的,那么Al(OH)3应该也可以写成H3AlO3。Mg(OH)2写成H2MgO2就无理了。由于之前(包括初中)讲的含氧酸的酸根都是非金属的,对金属出现在酸根中不少同学感觉别扭,其实熟知的著名氧化剂KMnO4就是由金属构成的酸根。
如果一种含氧酸脱水,留下的酸叫“偏酸”,H3AlO3脱水变成HAlO2,后者叫偏铝酸。类似的例子还有H3PO4脱水变成HPO3(偏磷酸)等。H2SO4与H2SO3的关系不是脱水而是脱氧,后者不叫偏酸而叫亚酸。偏酸中心原子的化合价没变,亚酸是变化的。
Al(OH)3电离OH-成为Al3+,这是碱式电离,电离很微弱,当然是可逆的。它的酸式电离却似乎先脱去一份H2O,使自己先变成一元酸,战斗力大为削弱,成为AlO2-。酸式电离也是极微弱的。
因此Al(OH)3的“两性”大概就是“左手三节棍、右手一把刀”。可惜两方面都很疲弱,不像那些强酸强碱,只有一件兵器,却很精良,兵来将挡很给力,水来则傻眼。
二.Al(OH)3的电子式
刚才有个漏洞没有说明,Al(OH)3在酸式电离时会脱去一份H2O,那么碱式电离时为什么不脱水?
两种电离(及其相应的化学反应方程式、化学计算)的“不对称”也让初学者感觉别扭和艰涩。
(写NH3、NH4+、Al(OH)3(共价化合物)的电子式)
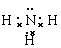
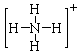
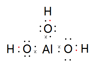
NH3很容易与H+结合变成NH4+,将H+换成H2O,该反应就变成了:NH3+H2O NH4++OH-
NH4++OH-
因此氨水是碱性的。
Al(OH)3的Al目前是6电子结构,因此有愿望与一个OH-结合,变成一种复杂离子Al(OH)4-(四羟基合铝)。将OH-换成H2O,该反应就是:Al(OH)3+H2O Al(OH)4-+H+
Al(OH)4-+H+
这是Al(OH)3也能表现酸性的真实原因。
这种多羟基结构往往是不太稳定的。有机化合物中的C原子由于半径更小,连两个羟基都受不了。Al(OH)4-会部分脱水变成AlO2-,整个过程就成为:Al(OH)3+H2O Al(OH)4-+H+
Al(OH)4-+H+ AlO2-+2H2O+H+
AlO2-+2H2O+H+
如果将中间过程撤去(不顾Al(OH)4-的存在),Al(OH)3的酸式电离才成为:
Al(OH)3 AlO2-+H2O+H+
AlO2-+H2O+H+
结果看上去像Al(OH)3脱水,其实脱水的是Al(OH)4-。
三.“3+1”和“1+3”
我们知道Al3+变成AlO2-需要4个OH-,4是3+1的结果。这个反应可以直接配平:
Al3++4OH-→AlO2-+2H2O(注意电荷配平)①
也可分成两步:
Al3++3OH-→Al(OH)3↓②
Al(OH)3+OH-→AlO2-+2H2O (注意两份H2O的两种出处)③
方程式中的OH-当然都代表强碱。②和③相加的结果就是①。
反过来,AlO2-变成Al3+需要4个H+,4是1+3的结果。这个反应可以直接配平:
AlO2-+4H+→Al3++2H2O(注意电荷配平)④
也可分成两步:
AlO2-+H++H2O→Al(OH)3↓⑤
Al(OH)3+3H+→Al3++3H2O⑥
方程式中的H+当然都代表强酸。⑤和⑥相加的结果就是④。
四.弱碱、弱酸
Al(OH)3的两种电离都极微弱,Al3+与OH-或AlO2-与H+的结合却是比较容易(下山容易上山难)。所以用氨水代替OH-进行反应②没有问题:
Al3++3NH4OH→Al(OH)3↓+3NH4+(代②)
却代替不了反应③,Al(OH)3与NH4OH两个巴掌都绵软,拍不出响来,Al(OH)3能溶于NaOH溶液不能溶于氨水。
同理,用CO2代替H+进行反应⑤没有问题:
AlO2-+CO2+2H2O→Al(OH)3↓+HCO3-(代⑤)
却代替不了反应⑥。
[实验]在Al2(SO4)3溶液中滴加氨水制取Al(OH)3沉淀物。将Al(OH)3分置两支试管,分别滴加盐酸和NaOH溶液,至沉淀消失。
五.Al2O3的两性
Al(OH)3受热分解:2Al(OH)3→Al2O3+3H2O⑦
这跟前面的“自动脱水”不一样,条件是刻意加热。
脱水是普遍存在的一种化学现象,比如H2CO3脱水为CO2、Mg(OH)2脱水为MgO、米被烧焦变成炭等。而脱水产物的化学性质往往与脱水前相似,比如CO2也是酸性(成盐后C出现在酸根)、MgO也是碱性(成盐后Mg作为阳离子)等。
Al2O3也是两性,且一份Al2O3相当于两份Al(OH)3。
Al2O3代替反应③,OH-的配平系数即为2:
Al2O3+2OH-→2AlO2-+H2O(代③)
Al2O3代替反应⑥,H+的配平系数即为6:
Al2O3+6H+→2Al3++3H2O(代⑥)

- 全部评论(0)
