镍氢电池介绍及在高考解题中应用
时间:2018-07-11 18:06 来源:未知 作者:化学自习室 点击:次 所属专题: 镍氢电池
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、镍氢电池的应用
民用通讯电源,各种便携式设备电源、电动工具、动力电源等。小型绿色电源,替代镉镍电池。

二、镍氢电池类型及原理
1、高压镍氢电池
(-)Pt,H2çKOH或NaOH çNiOOH(+)
正极活性物质: NiOOH(三价镍的氢氧化物)。
负极活性物质:Pt、Pd等贵金属为催化剂,负极活性物质是电池内预先充入的高压氢气。
电解液: KOH/NaOH
隔膜: 采用多孔维尼纶无纺布或尼龙无纺布。
负极反应式:
![]()
正极反应式:
![]()
优点:较高的比能量,循环寿命长,耐过充、过放能力强,以及可以通过氢压来指示电池荷电状态等。
缺点: ①需要贵金属催化剂,电池成本高; ②电池内部氢气压力高,增加了电池密封的难度和壳体材料选择上的限制; ③安全性差。
2、低压镍氢电池
(-)MHçKOH或NaOH çNiOOH(+)
正极活性物质: NiOOH(三价镍的氢氧化物)
负极活性物质: 储氢合金(MH)
电解液: KOH/NaOH
隔膜: 采用多孔维尼纶无纺布或尼龙无纺布
额定电压: 1.2V
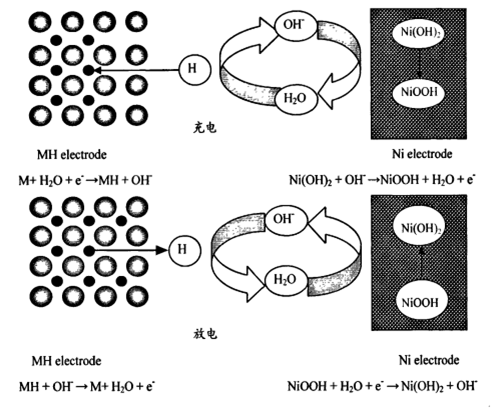
在电池充放电过程中的电池反应为:
氧化电极上:NiOOH+H2O+e-== Ni(OH)2+OH。
贮氢电极上:MH十OH-e- == M+H2O
电池总反应:MH + NiOOH == M+Ni(OH),其中,M表示贮氢合金材料。
充电时,正极上的Ni(OH)2转变为NiOOH,水分子在贮氢合金负极上放电,分解出氢原子吸附在电极表面上,形成吸附态的氢原子。再扩散到贮氢合金内部与贮氢合金发生反应形成金属氢化物。
放电时,NiOOH得到电子转变为Ni(OH)2,金属氢化物内部的氢原子扩散到表面而形成吸附态的氢原子,再发生电化学反应生成贮氢合金和水。
优点
1 能量密度高,是镍镉电他的1.5倍;
2 电池电压为1.2v—1.3v,与镍镉电池相当;
3 无记忆效应,循环寿命长 ;
4 可大电流放电,承受过充电、过放电能力强 ;
5 无污染,绿色环保电池 。
缺点
1 价格高于镍镉电池,负极材料为稀土合金材料;
2 自放电速度大。
三、在高考习题中应用
例1

【解析】
镍氢电池中主要为KOH作电解液,
放电时,
负极:MH+OH-→M+H2O+e-
正极:NiOOH+H2O+e-→Ni(OH)2+OH-,
总反应为:MH+NiOOH=M+Ni(OH)2。
充电时,
阴极反应:M+ H2O+e-=MH+ OH-,
阳极反应:Ni(OH)2+OH-= NiOOH+ H2O+e-,
总反应为:M+ Ni(OH)2=MH+ NiOOH;
以上各式中M为金属合金,MH为吸附了氢原子的储氢合金。
写电极反应式的关键是MH中M化合价是0,H化合价也是0,
A、放电时,正极:NiOOH+H2O+E-=Ni(OH)2+OH-,故A正确;
B、为了防止MH被氢离子氧化,镍氢电池中电解液为碱性溶液,主要为KOH作电解液,故B正确;
C、充电式,负极作阴极,阴极反应为M+H2O+e-=MH+OH-,故C错误;
D、M为储氢合金,MH为吸附了氢原子的储氢合金,储氢材料,其氢密度越大,电池的能量密度越高,故D正确;
例2
(2014年浙江)11. 镍氢电池(NiMH)目前已经成为混合动力汽车的一种主要电池类型,NiMH中的M表示储氢金属或合金,该电池在充电过程中的总反应方程式是Ni(OH)2+M===NiOOH+MH。
已知:6NiOOH+NH3+H2O+OH-===6Ni(OH)2+NO
下列说法正确的是( )
A.NiMH电池放电过程中,正极的电极反应式为NiOOH+H2O+e-===Ni(OH)2+OH-
B.充电过程中OH-从阳极向阴极迁移
C.充电过程中阴极的电极反应式:H2O+M+e-===MH+OH-,H2O中的H被M还原
D.NiMH电池中可以用KOH溶液、氨水等作为电解质溶液
答案A
【解析】该电池在充电过程中的总反应方程式是Ni(OH)2+M===NiOOH+MH。其放电时总反应为MH+ NiOOH= M+ Ni(OH)2;
负极:MH+OH-→M+H2O+e-
正极:NiOOH+H2O+e-→Ni(OH)2+OH-,
A 放电时正极发生的是得电子的还原反应,A项正确;
充电时阴离子移向阳极,B错项误;
充电时,被还原的是氢元素,生成的H2被储氢合金M吸收起来,M不参与反应,C项错误;
因为6NiOOH + NH3 + H2O+OH-===6Ni(OH)2 + NO,故NiMH电池中不可以同时使用KOH溶液、氨水,D项错误。
例3
例4
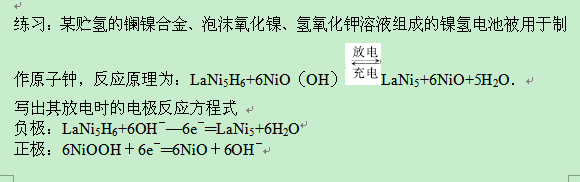
常见镍氢电池的某电极材料是储氢合金LaNi5H6(LaNi5H6中各元素化合价均为零),电池反应通常表示为:LaNi5+6Ni(OH)2==LaNi5H6+6NiO(OH),下列说法正确的是( )
A.放电时,储氢合金作正极
B.放电时,负极反应:LaNi5H6+6OH--6e-=LaNi5+6H2O
C.充电时,阳极周围c(OH-)增大
D.充电时,储氢合金作阳极
【解析】此电池放电时的反应为LaNi5H6+6NiOH=LaNi5+6Ni(OH)2,正极反应为6NiOOH+6e-=6Ni(OH)2+6OH-,负极反应为 L aNi5H6-6e-+6OH-=LaNi5+6H2O.由此可见储氢合金是还原剂,作原电池的负极.充电时的总反应为LaNi5+6Ni(OH)2=LaNi5H6+6NiOOH,阳极反应为6Ni(OH)2+6OH-+6e-=6NiOOH+6H2O,阴极反应为LaNi5+6H2O-6e-=LaNi5H6+6OH-。
A、放电时是原电池,依据总反应化学方程式可知,储氢合金做电池的负极,故错误;
B、放电时,负极失电子发生氧化反应,电极反应为:LaNi5H6+6OH--6e-=LaNi5+6H2O,故正确;
C、充电时电解池,阳极电极反应为:6Ni(OH)2+6OH-+6e-=6NiOOH+6H2O,氢氧根离子浓度减小,故C错误;
D、充电时,储氢合金失电子发生氧化反应,作阴极,故D错误;
故选B.

- 全部评论(0)
