铜及其化合物性质总结
时间:2020-01-03 15:42 来源:未知 作者:化学自习室 点击:次 所属专题: 铜及其化合物
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
铜是人类最早发现和应用的金属之一,紫红色,密度大,熔沸点高,有很好的延展性、导热、导电性。
晶体为面心立方结构。化合价通常为+2,也有+1,焰色反应为绿色;原子结构有四个电子层,电子层:K、L、M、N层分别有2、8、18、1个电子,电子排布式为1s22s22p63s23p63d104s1。Cu的活动性在氢之后,不能与稀盐酸稀硫酸反应,但可以和氧化性的酸如浓硫酸、硝酸反应。单质及其化合物有很丰富的颜色如
Cu:紫红色;CuO:黑色;Cu2O:红色;Cu2(OH)2CO3:绿色;CuSO4(无水物)为白色,溶液和晶体为蓝色;CuCl2溶液(稀溶液为蓝色,浓溶液为绿色);CuS、Cu2S为黑色。
一、铜单质
1.与氧气反应:2Cu+O2 2CuO,继续在很高温度下燃烧,就生成红色的Cu2O:4Cu+O2
2CuO,继续在很高温度下燃烧,就生成红色的Cu2O:4Cu+O2 2Cu2O。
2Cu2O。
2.在潮湿的空气中久置,慢慢生成铜绿(碱式碳酸铜),其组成是可变的。
2Cu+O2+H2O+CO2=Cu2(OH)2CO3[或xCu(OH)2·yCuCO3]
3.Cu与Cl2反应显高价(+2),与S反应显低价(+1)。
Cu+Cl2 CuCl2
CuCl2
2Cu+S(蒸汽) Cu2S
Cu2S
4.电子工业常用FeCl3溶液来刻蚀铜以制造印刷线路:
Cu+2FeCl3=2FeCl2+CuCl2
5.与空气和稀酸反应
铜不能置换稀酸中的氢。但有O2存在时,铜氧化生成氧化铜,CuO再缓慢溶于稀盐酸(硫酸)中:
2Cu+4H++O2=2Cu2++2H2O
6.与氧化性酸反应
铜易为HNO3、热浓硫酸等氧化性酸氧化而溶解:
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
7.铜可以用作乙醇氧化的催化剂
2CH3CH2OH+O2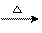 2CH3CHO+2H2O
2CH3CHO+2H2O
二、铜的化合物
铜(I)又称亚铜,氯化亚铜(CuCl)、氧化亚铜都是常见的一价铜化合物。铜(II)是铜最常见的价态,
铜(II)可以形成一系列的配离子,如[Cu(H2O)4]2+蓝色、[CuCl4]2-黄绿、[Cu(NH3)4]2+深蓝等。五水合硫酸铜化学式CuSO₄·5H₂O,呈蓝色,俗称胆矾(蓝矾)。
1.无水硫酸铜实验中检验水蒸气(观察白色是否变蓝):CuSO4+5H2O=CuSO4·5H2O。
2.在硫酸铜溶液中逐滴加入过量氨水,先生成蓝色沉淀,沉淀溶解,得到深蓝色溶液;加入无水乙醇,又得到深蓝色晶体[Cu(NH3)4]SO4·H2O:
Cu2++2NH3·H2O=Cu(OH)2+2NH4+
Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-
3.用惰性电极电解CuSO4溶液:
2Cu2++2H2O  2Cu+4H++O2↑
2Cu+4H++O2↑
4.向CuSO4溶液中通入H2S气体,现象有黑色沉淀生成:Cu2++H2S=CuS↓+2H+,该反应能发生是因为生成难溶物,而不是弱酸可以制备强酸的佐证。
5.铜的化合物能杀菌消毒。农业上用波尔多液来杀菌消毒:CuSO4+Ca(OH)2=CaSO4+Cu(OH)2。
三、铜的冶炼
铜矿石有孔雀石(Cu₂(OH)₂CO₃)、黄铜矿(CuFeS₂)、辉铜矿(Cu₂S)、赤铜矿(Cu₂O)等。
1.湿法炼铜:Fe+CuSO4=Cu+FeSO4
2.火法炼铜:Cu₂S+O₂ 2Cu+SO₂↑
2Cu+SO₂↑
3.铜的电解精炼:以粗铜做阳极,纯铜做阴极,CuSO4溶液做电解质,即可在阴极得到精铜:
阳极反应:Zn-2e-=Zn2+,Fe-2e-=Fe2+,Ni-2e-=Ni2+,Cu-2e-=Cu2+
阴极反应:Cu2++2e-=Cu

- 全部评论(0)
(1471458492) 评论 铜及其化合物性质总结:很有帮助 i了i了
