浅议两性氢氧化物的特性
时间:2021-12-18 14:35 来源:未知 作者:化学自习室 点击:次 所属专题: 两性氢氧化物
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
在中学化学教材的无机部分,曾涉及到一种比较特殊的化合物——两性氢氧化物。如:Al(OH)3,Zn(OH)2等。搞清形成这类物质固有特性的内因和外因,对我们提高这部分知识的课堂教学效果将起到有益作用。
1、何谓两性氢氧化物
两性氢氧化物,是指在溶液中既能电离出H+离子,又能电离出OH-离子的氢氧化物。用通式ROH表示这类物质,那么它们在溶液中一般存在着酸式和碱式两种电离方式。
即:
碱式电离ROH→R++OH-`(1)
酸式电离ROH→RO-+H+(2)
2、造成两性氢氧化物特性的内在原因
两性氢氧化物只所以具有两性的特点,能按两种方式电离。这是因为ROH分子中R—O和O—H都是极性键,在H2O的作用下都有断键的可能。电离时,由哪一个键断裂,这要看R—O键和O一H键的担对强弱。若R一O键强于O一H键,则按(2)式进行酸式电离,如果R一O键弱于O一H键,则按(1)式进行碱式电离,如果R一O键与O一H键的相对强弱接近或相等,那么,ROH就有酸式和碱式两种电离趋势,这就使得ROH具有两性的特性。
不难看出:在ROH中R—O键和O—H键的相对强弱取决于R+离子,H+离子分别对O2-离子的吸引力。由于H+离子对O2-离子的吸引力是一定的,所以两个键的相对强弱实际上取决于R+离子对O2-离子的吸引力的大小。根据库仑定律。这种吸引力主要决定于R+离子的电荷数Z和离子的半径。如把这两种因素联系起来,用离子势![]() 表示,则:
表示,则:
![]()
式中![]() 值的大小,决定了R+离子对O2-离子吸引力的强弱,决定了R一O键的强弱,从而决定了ROH是按碱式电离,还是按酸式电离,还是两种电离的趋势都具有。进而我们从电离势
值的大小,决定了R+离子对O2-离子吸引力的强弱,决定了R一O键的强弱,从而决定了ROH是按碱式电离,还是按酸式电离,还是两种电离的趋势都具有。进而我们从电离势![]() 值的大小上,可判断出ROH是否是两性氢氧化物。
值的大小上,可判断出ROH是否是两性氢氧化物。
3、两性氢氧化物的判断
在具体应用中ROH是否是两性氢氧化物,我们可根据如下经验判断数据来判断;
![]() (其中:离子半径r:用
(其中:离子半径r:用 作单位。)
作单位。)
据此,我们可计算离子势![]() 的平方根值来判断ROH是否是两性氢氧化物。
的平方根值来判断ROH是否是两性氢氧化物。
例如:Al3+的离子半径r=0.50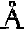
电荷数Z=3

故Al(OH)3为两性氢氧化物。
通过对元素周期系的学习,使我们认识到在周期表中,从左到右,元素最高价氧化物对应的水化物的变化规律是由碱性变为酸性,而元素周期表中位于金属与非金属交界线附近的元素如:Al、Ga、In、Ge等它们氧化物的水化物都具有较为明显的两性。
4、影响两性氢氧化物性质的主要外界因素
由于两性氢氧化物,以Al(OH)3为例,在水溶液中存在着两种电离平衡:
Al(OH)3 Al3++3OH-(l)
Al3++3OH-(l)
Al(OH)3 H2O+AlO2-+H+(2)
H2O+AlO2-+H+(2)
所以,促使Al(OH)3向(1)式碱式电离进行还是向(2)式酸式电离进行的主要外因是溶液中酸和碱的浓度。
当向Al(OH)3里加入酸时,H+立即跟溶液中OH-起反应生成水,打破了原来的平衡,使电离向(1)式的碱式电离进行,此时,Al(OH)3以碱的形式出现。如果向Al(OH)3溶液中加入碱时,OH-会跟原溶液中的H+反应生成水,使原来的平衡向(2)式的酸式电离进行,此时Al(OH)3就显示出碱性。因此,我们说决定两性氢氧化物以哪种性质(酸性、碱性)出现的外界因素主要在于外来物质的酸碱溶液。

- 全部评论(0)
