2024年甘肃普通高中学业水平选择性考试化学试题
时间:2024-07-05 21:26 来源:未知 作者:化学自习室 点击:次 所属专题: 新高考题库
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
【2024甘肃等级考】1. 下列成语涉及金属材料的是
A. 洛阳纸贵 B. 聚沙成塔 C. 金戈铁马 D. 甘之若饴
【答案】C
【解析】
【详解】A.纸的主要成分是纤维素,不是金属材料,A错误;
B.沙的主要成分是硅酸盐,不是金属材料,B错误;
C.金和铁都是金属,C正确;
D.甘之若饴意思是把它看成像糖那样甜,糖类是有机物,不是金属材料,D错误;
故选C。
【2024甘肃等级考】2. 下列化学用语表述错误的是
A. Ca2+和Cl-的最外层电子排布图均为
B. PH3和H2S的电子式分别为 和
和
C. CH2=CHCH2CH2CH3的分子结构模型为
D.  、
、 和
和 互为同位素
互为同位素
【答案】B
【解析】
【详解】A.Ca2+和Cl-的核外电子数都是18,最外层电子排布图均为 ,故A正确;
,故A正确;
B.PH3中磷原子和每个氢原子共用一对电子,中心原子P原子价层电子对数为3+ ×(5-3×1)=4,孤电子对数为1,PH3的电子式为
×(5-3×1)=4,孤电子对数为1,PH3的电子式为 ,故B错误;
,故B错误;
C.CH2=CHCH2CH2CH3分子中存在1个碳碳双键,位于1号碳原子与2号碳原子之间,存在3个碳碳单键,无支链,且氢原子半径小于碳原子半径,其分子结构模型表示为 ,故C正确;
,故C正确;
D. 、
、 和
和 是质子数相同、中子数不同的碳原子,是碳元素的不同核素,互为同位素,故D正确;
是质子数相同、中子数不同的碳原子,是碳元素的不同核素,互为同位素,故D正确;
故选B
【2024甘肃等级考】3. 化学与生活息息相关,下列对应关系错误的是
物质 | 性质 | 用途 | |
A | 次氯酸钠 | 氧化性 | 衣物漂白 |
B | 氢气 | 可燃性 | 制作燃料电池 |
C | 聚乳酸 | 生物可降解性 | 制作一次性餐具 |
D | 活性炭 | 吸附性 | 分解室内甲醛 |
A. A B. B C. C D. D
【答案】D
【解析】
【详解】A.次氯酸钠有强氧化性,从而可以做漂白剂,用于衣物漂白,A正确;
B.氢气是可燃气体,具有可燃性,能被氧气氧化,可以制作燃料电池,B正确;
C.聚乳酸具有生物可降解性,无毒,是高分子化合物,可以制作一次性餐具,C正确;
D.活性炭有吸附性,能够有效吸附空气中的有害气体、去除异味,但无法分解甲醛,D错误;
故本题选D。
【2024甘肃等级考】4. 下列措施能降低化学反应速率的是
A. 催化氧化氨制备硝酸时加入铂 B. 中和滴定时,边滴边摇锥形瓶
C. 锌粉和盐酸反应时加水稀释 D. 石墨合成金刚石时增大压强
【答案】C
【解析】
【详解】A.催化剂可以改变化学反应速率,一般来说,催化剂可以用来加快化学反应速率,故催化氧化氨制备硝酸时加入铂可以加快化学反应速率,A项不符合题意;
B.中和滴定时,边滴边摇锥形瓶,可以让反应物快速接触,可以加快化学反应速率,B项不符合题意;
C.锌粉和盐酸反应时加水稀释会降低盐酸的浓度,会降低化学反应速率,C项符合题意;
D.石墨合成金刚石,该反应中没有气体参与,增大压强不会改变化学反应速率,D项不符合题意;
故选C。
【2024甘肃等级考】5. X、Y、Z、W、Q为短周期元素,原子序数依次增大,最外层电子数之和为18。Y原子核外有两个单电子,Z和Q同族,Z的原子序数是Q的一半,W元素的焰色试验呈黄色。下列说法错误的是
A. X、Y组成的化合物有可燃性 B. X、Q组成的化合物有还原性
C. Z、W组成的化合物能与水反应 D. W、Q组成的化合物溶于水呈酸性
【答案】D
【解析】
【分析】X、Y、Z、W、Q为短周期元素,W元素的焰色试验呈黄色,W为Na元素;Z和Q同族,Z的原子序数是Q的一半,则Z为O、Q为S;Y原子核外有两个单电子、且原子序数小于Z,Y为C元素;X、Y、Z、W、Q的最外层电子数之和为18,则X的最外层电子数为18-4-6-1-6=1,X可能为H或Li。
【详解】A.若X为H,H与C组成的化合物为烃,烃能够燃烧,若X为Li,Li与C组成的化合物也具有可燃性,A项正确;
B.X、Q组成的化合物中Q(即S)元素呈-2价,为S元素的最低价,具有还原性,B项正确;
C.Z、W组成的化合物为Na2O、Na2O2,Na2O与水反应生成NaOH,Na2O2与水反应生成NaOH和O2,C项正确;
D.W、Q组成的化合物Na2S属于强碱弱酸盐,其溶于水所得溶液呈碱性,D项错误;
答案选D。
【2024甘肃等级考】6. 下列实验操作对应的装置不正确的是
A | B | C | D |
灼烧海带制海带灰 | 准确量取15.00mL稀盐酸 | 配制一定浓度的NaCl溶液 | 使用电石和饱和食盐水制备C2H2 |
|
|
|
|
A. A B. B C. C D. D
【答案】A
【解析】
【详解】A.灼烧海带制海带灰应在坩埚中进行,并用玻璃棒搅拌,给坩埚加热时不需要使用石棉网或陶土网,A项错误;
B.稀盐酸呈酸性,可用酸式滴定管量取15.00mL稀盐酸,B项正确;
C.配制一定浓度的NaCl溶液时,需要将在烧杯中溶解得到的NaCl溶液通过玻璃棒引流转移到选定规格的容量瓶中,C项正确;
D.电石的主要成分CaC2与水发生反应CaC2+2H2O→Ca(OH)2+CH≡CH↑制取C2H2,该制气反应属于固体与液体常温制气反应,分液漏斗中盛放饱和食盐水,具支锥形瓶中盛放电石,D项正确;
答案选A。
【2024甘肃等级考】7. 某固体电解池工作原理如图所示,下列说法错误的是

A. 电极1的多孔结构能增大与水蒸气的接触面积
B. 电极2是阴极,发生还原反应:O2+4e-=2O2-
C. 工作时O2-从多孔电极1迁移到多孔电极2
D. 理论上电源提供2mol e-能分解1molH2O
【答案】B
【解析】
【分析】多孔电极1上H2O(g)发生得电子的还原反应转化成H2(g),多孔电极1为阴极,电极反应为2H2O+4e-=2H2+2O2-;多孔电极2上O2-发生失电子的氧化反应转化成O2(g),多孔电极2为阳极,电极反应为2O2--4e-=O2。
【详解】A.电极1的多孔结构能增大电极的表面积,增大与水蒸气的接触面积,A项正确;
B.根据分析,电极2为阳极,发生氧化反应:2O2--4e-=O2,B项错误;
C.工作时,阴离子O2-向阳极移动,即O2-从多孔电极1迁移到多孔电极2,C项正确;
D.根据分析,电解总反应为2H2O(g) 2H2+O2,分解2molH2O转移4mol电子,则理论上电源提供2mol电子能分解1molH2O,D项正确;
2H2+O2,分解2molH2O转移4mol电子,则理论上电源提供2mol电子能分解1molH2O,D项正确;
答案选B。
【2024甘肃等级考】8. 曲美托嗪是一种抗焦虑药,合成路线如下所示,下列说法错误的是

A. 化合物I和Ⅱ互为同系物
B. 苯酚和(CH3O)2SO2在条件①下反应得到苯甲醚
C. 化合物Ⅱ能与NaHCO3溶液反应
D. 曲美托嗪分子中含有酰胺基团
【答案】A
【解析】
【详解】A.化合物Ⅰ含有的官能团有羧基、酚羟基,化合物Ⅱ含有的官能团有羧基、醚键,官能团种类不同,化合物Ⅰ和化合物Ⅱ不互为同系物,A项错误;
B.根据题中流程可知,化合物Ⅰ中的酚羟基与(CH3O)2SO2反应生成醚,故苯酚和(CH3O)2SO2在条件①下反应得到苯甲醚,B项正确;
C.化合物Ⅱ中含有羧基,可以与NaHCO3溶液反应,C项正确;
D.由曲美托嗪的结构简式可知,曲美托嗪中含有的官能团为酰胺基、醚键,D项正确;
故选A。
【2024甘肃等级考】9. 下列实验操作、现象和结论相对应的是
实验操作、现象 | 结论 | |
A | 用蓝色石蕊试纸检验某无色溶液,试纸变红 | 该溶液是酸溶液 |
B | 用酒精灯灼烧织物产生类似烧焦羽毛的气味 | 该织物含蛋白质 |
C | 乙醇和浓硫酸加热,产生的气体使溴水褪色 | 该气体是乙烯 |
D | 氯化镁溶液中滴入氢氧化钠溶液,生成沉淀 | 氢氧化钠的碱性比氢氧化镁强 |
A. A B. B C. C D. D
【答案】B
【解析】
【详解】A.用蓝色石蕊试纸检验某无色溶液,试纸变红,该溶液显酸性,但不一定是酸溶液,也有可能是显酸性的盐溶液,A项不符合题意;
B.动物纤维主要成分是蛋白质,灼烧后有类似烧焦羽毛的味道,若用酒精灯灼烧织物产生类似烧焦羽毛的味道,说明该织物含有动物纤维,含有蛋白质,B项符合题意;
C.乙醇和浓硫酸加热,会产生很多产物,如加热温度在170℃,主要产物为乙烯;如加热温度在140℃,主要产物为二乙醚;同时乙醇可在浓硫酸下脱水生成碳单质,继续和浓硫酸在加热条件下产生二氧化碳、二氧化硫等,其中的产物二氧化硫也能使溴水褪色,不能说明产生的气体就是乙烯,C项不符合题意;
D.氯化镁溶液中滴入氢氧化钠溶液,会发生复分解反应,生成难溶的氢氧化镁,与氢氧化钠和氢氧化镁的碱性无关,不能由此得出氢氧化钠的碱性比氢氧化镁强,D项不符合题意;
故选B。
【2024甘肃等级考】10. 甲烷在某含Mo催化剂作用下部分反应的能量变化如图所示,下列说法错误的是

A.E2=1.41eV
B. 步骤2逆向反应的ΔH=+0.29eV
C. 步骤1的反应比步骤2快
D. 该过程实现了甲烷的氧化
【答案】C
【解析】
【详解】A.由能量变化图可知,E2=070eV-(-0.71eV)=1.41eV,A项正确;
B.由能量变化图可知,步骤2逆向反应的ΔH=-0.71eV-(-1.00eV)=+0.29eV,B项正确;
C.由能量变化图可知,步骤1的活化能E1=0.70eV,步骤2的活化能E3=-0.49eV-(-0.71eV)=0.22eV,步骤1的活化能大于步骤2的活化能,步骤1的反应比步骤2慢,C项错误;
D.该过程甲烷转化为甲醇,属于加氧氧化,该过程实现了甲烷的氧化,D项正确;
故选C。
【2024甘肃等级考】11. 兴趣小组设计了从AgCl中提取Ag的实验方案,下列说法正确的是

A. 还原性:Fe > Cu > Ag
B. 按上述方案消耗1 mol Fe可回收1 mol Ag
C. 反应①的离子方程式是[Cu(NH3)4]2++4H+=Cu2++4NH4+
D. 溶液①中的金属离子是Fe2+
【答案】C
【解析】
【分析】从实验方案可知,氨水溶解了氯化银,然后用铜置换出银,滤液中加入浓盐酸后得到氯化铜和氯化铵的混合液,向其中加入铁、铁置换出铜,过滤分铜可以循环利用,并通入氧气可将亚铁离子氧化为铁离子。
【详解】A.金属活动性越强,金属的还原性越强,而且由题中的实验方案能得到证明,还原性从强到弱的顺序为 Fe > Cu > Ag,A不正确;
B.由电子转移守恒可知,1 mol Fe可以置换1 mol Cu,而1 mol Cu可以置换2 mol Ag,因此,根据按上述方案消耗1 mol Fe可回收2 mol Ag,B不正确;
C.反应①中,氯化四氨合铜溶液与浓盐酸反应生成氯化铜和氯化铵,该反应的离子方程式是[Cu(NH3)4]2++4H+=Cu2++4NH4+,C正确;
D.向氯化铜和氯化铵的混合液中加入铁,铁换置换出铜后生成Fe2+,然后Fe2+被通入的氧气氧化为Fe3+,氯化铁和氯化铵水解均使溶液呈酸性二者可共存,因此,溶液①中的金属离子是Fe3+,D不正确;
综上所述,本题选C。
【2024甘肃等级考】12.β-MgCl2 晶体中,多个晶胞无隙并置而成的结构如图甲所示,其中部分结构显示为图乙,下列说法错误的是

A. 电负性:Mg<Cl B. 单质Mg是金属晶体
C. 晶体中存在范德华力 D.Mg2+离子的配位数为3
【答案】D
【解析】
【详解】A.电负性越大的元素吸引电子的能力越强,活泼金属的电负性小于活泼非金属,因此,Mg的电负性小于 Cl,A正确;
B.金属晶体包括金属单质及合金,单质Mg是金属晶体,B正确;
C.由晶体结构可知,该结构中存在层状结构,层与层之间存在范德华力,C正确;
D.由图乙中结构可知,每 个Mg2+与周围有6个Cl-最近且距离相等,因此 ,Mg2+的配位数为6,D错误;
综上所述,本题选D。
温室气体N2O在催化剂作用下可分解为O2和N2,也可作为氧化剂氧化苯制苯酚。据此完成下面小题。
【2024甘肃等级考】13. 下列说法错误的是
A. 原子半径:O<N <C B. 第一电离能:C< N< O
C. 在水中的溶解度:苯<苯酚 D. 苯和苯酚中C的杂化方式相同
14. 下列说法错误的是
A. 相同条件下N2比O2稳定
B. N2O与 的空间构型相同
的空间构型相同
C. N2O中N-O键比N-N键更易断裂
D.N2O中σ键和大π键的数目不相等
【答案】13. B 14. D
【解析】
【13题详解】
A. C 、N 、O都是第二周期的元素,其原子序数依次递增;同一周期的元素,从左到右原子半径依次减小,因此,原子半径从小到大的顺序为O<N<C,A正确;
B.同一周期的元素,从左到右电负性呈递增的趋势,其中ⅡA和ⅤA的元素因其原子结构相对较稳定而出现反常,使其电负性大于同周期相邻的元素,因此,第一电离能从小到大的顺序为C< O< N,B不正确;
C.苯是非极性分子,苯酚是极性分子,且苯酚与水分子之间可以形成氢键,根据相似相溶规则可知,苯酚在水中的溶解度大于苯,C正确;
D.苯和苯酚中C的杂化方式均为sp2,杂化方式相同,D正确;
综上所述,本题选B。
【14题详解】
A.N2分子中存在的N≡N,O2分子中虽然也存在叁键,但是其键能小于N≡N,因此,相同条件下N2比O2稳定,A正确;
B.N2O与 均为CO2的等电子体,故其均为直线形分子,两者空间构型相同,B正确;
均为CO2的等电子体,故其均为直线形分子,两者空间构型相同,B正确;
C.N2O的中心原子是N,其在催化剂作用下可分解为O2和N2,说明N2O中N-O键比N-N键更易断裂,C正确;
D.N2O中σ键和大π键的数目均为2,因此,σ键和大π键的数目相等,D不正确;
综上所述,本题选D。
二、非选择题:本题共4小题,共58分。
【2024甘肃等级考】15. 我国科研人员以高炉渣(主要成分为CaO,MgO,Al2O3和SiO2等)为原料,对炼钢烟气(CO2和水蒸气)进行回收利用,有效减少了环境污染,主要流程如图所示:

已知:Ksp(CaSO4)=4.9×10-5 Ksp(CaCO3)=3.4×10-9
(1)高炉渣与(NH4)2SO4经焙烧产生的“气体”是_______。
(2)“滤渣”的主要成分是CaSO4和_______。
(3)“水浸2”时主要反应的化学方程式为_______,该反应能进行的原因是_______。
(4)铝产品NH4Al(SO4)2·12H2O可用于_______。
(5)某含钙化合物的晶胞结构如图甲所示,沿x轴方向的投影为图乙,晶胞底面显示为图丙,晶胞参数a≠c,α=β=γ=90°。图丙中Ca与N的距离为_______pm;化合物的化学式是_______,其摩尔质量为M g/mol,阿伏加德罗常数的值是NA,则晶体的密度为_______g/cm3(列出计算表达式)。

【答案】(1)NH3 (2)SiO2
(3) ①.CaSO4+(NH4)2CO3=CaCO3+(NH4)2SO4 ②.Ksp(CaSO4)>Ksp(CaCO3),微溶的硫酸钙转化为更难溶的碳酸钙
(4)净水 (5) ①.  ②. Ca3N3B ③.
②. Ca3N3B ③. 
【解析】
【分析】高炉渣(主要成分为CaO,MgO,Al2O3和SiO2等)加入(NH4)2SO4在400℃下焙烧,生成硫酸钙、硫酸镁、硫酸铝,同时产生气体,该气体与烟气(CO2和水蒸气)反应,生成(NH4)2CO3,所以该气体为NH3;焙烧产物经过水浸1,然后过滤,滤渣为CaSO4以及未反应的SiO2,滤液溶质主要为硫酸镁、硫酸铝及硫酸铵;滤液浓缩结晶,析出NH4Al(SO4)2·12H2O,剩余富镁溶液;滤渣加入(NH4)2CO3溶液,滤渣中的CaSO4会转化为更难溶的碳酸钙。
【小问1详解】
由分析可知,高炉渣与(NH4)2SO4经焙烧产生的“气体”是NH3;
【小问2详解】
由分析可知,“滤渣”的主要成分是CaSO4和未反应的SiO2;
【小问3详解】
“水浸2”时主要反应为硫酸钙与碳酸铵生成更难溶的碳酸钙,反应方程式为CaSO4+(NH4)2CO3=CaCO3+(NH4)2SO4,该反应之所以能发生,是由于Ksp(CaSO4)=4.9×10-5 Ksp(CaCO3)=3.4×10-9,Ksp(CaSO4)>Ksp(CaCO3),微溶的硫酸钙转化为更难溶的碳酸钙;
【小问4详解】
铝产品NH4Al(SO4)2·12H2O溶于水后,会产生Al3+,Al3+水解生成Al(OH)3胶体,可用于净水;
【小问5详解】
图丙中,Ca位于正方形顶点,N位于正方形中心,故Ca与N的距离为 pm;由均摊法可知,晶胞中Ca的个数为
pm;由均摊法可知,晶胞中Ca的个数为 ,N的个数为
,N的个数为 ,B的个数为
,B的个数为 ,则化合物的化学式是Ca3N3B;其摩尔质量为Mg/mol,阿伏加德罗常数的值是NA,晶胞体积为
,则化合物的化学式是Ca3N3B;其摩尔质量为Mg/mol,阿伏加德罗常数的值是NA,晶胞体积为 则晶体的密度为
则晶体的密度为 。
。
【2024甘肃等级考】16. 某兴趣小组设计了利用MnO2和H2SO3生成MnS2O6,再与Na2CO3反应制备MnS2O6·2H2O的方案:

(1)采用下图所示装置制备SO2,仪器a的名称为_______;步骤I中采用冰水浴是为了_______;

(2)步骤Ⅱ应分数次加入MnO2,原因是_______;
(3)步骤Ⅲ滴加饱和Ba(OH)2溶液的目的是_______;
(4)步骤Ⅳ生成MnCO3沉淀,判断Mn2+已沉淀完全的操作是_______;
(5)将步骤Ⅴ中正确操作或现象的标号填入相应括号中_______。

A.蒸发皿中出现少量晶体
B.使用漏斗趁热过滤
C.利用蒸发皿余热使溶液蒸干
D.用玻璃棒不断搅拌
E.等待蒸发皿冷却
【答案】(1) ①. 恒压滴液漏斗 ②. 增大SO2的溶解度、增大H2SO3的浓度,同时为步骤Ⅱ提供低温
(2)防止过多的MnO2与H2SO3反应生成MnSO4,同时防止反应太快、放热太多、不利于控制温度低于10℃
(3)除去过量的SO2(或H2SO3)
(4)静置,向上层清液中继续滴加几滴饱和Na2CO3溶液,若不再产生沉淀,说明Mn2+已沉淀完全
(5)D、A、E
【解析】
【分析】步骤Ⅱ中MnO2与H2SO3在低于10℃时反应生成MnS2O6,反应的化学方程式为MnO2+2H2SO3=MnS2O6+2H2O,步骤Ⅲ中滴加饱和Ba(OH)2除去过量的SO2(或H2SO3),步骤Ⅳ中滴入饱和Na2CO3溶液发生反应MnS2O6+Na2CO3=MnCO3↓+Na2S2O6,经过滤得到Na2S2O6溶液,步骤Ⅴ中Na2S2O6溶液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到Na2S2O6∙2H2O。
【小问1详解】
根据仪器a的特点知,仪器a为恒压滴液漏斗;步骤Ⅰ中采用冰水浴是为了增大SO2的溶解度、增大H2SO3的浓度,同时为步骤Ⅱ提供低温;
【小问2详解】
由于MnO2具有氧化性、SO2(或H2SO3)具有还原性,步骤Ⅱ应分数次加入MnO2,原因是:防止过多的MnO2与H2SO3反应生成MnSO4,同时防止反应太快、放热太多、不利于控制温度低于10℃;
【小问3详解】
步骤Ⅲ中滴加饱和Ba(OH)2溶液的目的是除去过量的SO2(或H2SO3),防止后续反应中SO2与Na2CO3溶液反应,增加饱和Na2CO3溶液的用量、并使产品中混有杂质;
【小问4详解】
步骤Ⅳ中生成MnCO3沉淀,判断Mn2+已沉淀完全的操作是:静置,向上层清液中继续滴加几滴饱和Na2CO3溶液,若不再产生沉淀,说明Mn2+已沉淀完全;
【小问5详解】
步骤Ⅴ的正确操作或现象为:将滤液倒入蒸发皿中→用酒精灯加热→用玻璃棒不断搅拌→蒸发皿中出现少量晶体→停止加热→等待蒸发皿冷却→过滤、洗涤、干燥得到Na2S2O6∙2H2O,依次填入D、A、E。
【2024甘肃等级考】17.SiHCl3 是制备半导体材料硅的重要原料,可由不同途径制备。
(1)由SiCl4制备SiHCl3 :SiCl4(g)+H2(g)=SiHCl3(g)+HCl(g) ΔH1=+74.22kJ/mol (298K)
已知SiCl4(g)+H2(g)=Si(s)+3HCl(g) ΔH2=+219.29kJ/mol(298K)
298K时,由SiCl4(g)+H2(g)=Si(s)+4HCl(g)制备56g硅_______(填“吸”或“放”)热_______kJ。升高温度有利于制备硅的原因是_______。
(2)在催化剂作用下由粗硅制备SiHCl3 :3SiCl4(g)+2H2(g)+Si(s)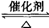 4SiHCl3(g)。773K,2L密闭容器中,经不同方式处理的粗硅和催化剂混合物与0.4molH2和0.1molSiCl4气体反应,SiCl4转化率随时间的变化如下图所示:
4SiHCl3(g)。773K,2L密闭容器中,经不同方式处理的粗硅和催化剂混合物与0.4molH2和0.1molSiCl4气体反应,SiCl4转化率随时间的变化如下图所示:

①0-50min,经方式_______处理后的反应速率最快;在此期间,经方式丙处理后的平均反应速率v(SiHCl3)=_______mol/(L·min)。
②当反应达平衡时,H2的浓度为_______mol/L,平衡常数K的计算式为_______。
③增大容器体积,反应平衡向_______移动。
【答案】(1) ①. 吸 ②. 587.02 ③. 该反应为吸热反应,升高温度,反应正向移动,有利于制备硅
(2) ① 甲 ②.5.6×10-5 ③. 0.1952 ④.
甲 ②.5.6×10-5 ③. 0.1952 ④.  ⑤. 逆反应方向
⑤. 逆反应方向
【解析】
【小问1详解】
由题给热化学方程式:①SiCl4(g)+H2(g)=SiHCl3(g)+HCl(g) ΔH1=+74.22kJ/mol ;②SiCl4(g)+H2(g)=Si(s)+3HCl(g) ΔH2=+219.29kJ/mol;则根据盖斯定律可知,①+②,可得热化学方程式SiCl4(g)+H2(g)=Si(s)+4HCl(g), ,则制备56gSi,即2molSi,需要吸收热量为
,则制备56gSi,即2molSi,需要吸收热量为 ;该反应为吸热反应,升高温度,反应正向移动,有利于制备硅。
;该反应为吸热反应,升高温度,反应正向移动,有利于制备硅。
【小问2详解】
①由转化率图像可知,0-50min,经方式甲处理后反应速率最快;经方式丙处理后,50min时SiCl4的转化率为4.2%,反应的SiCl4的物质的量为0.1mol×4.2%=0.0042mol,根据化学化学计量数可得反应生成的SiHCl3的物质的量为 ,平均反应速率
,平均反应速率 ;
;
②反应达到平衡时,SiCl4的转化率为14.6%,列出三段式为:

当反应达平衡时,H2的浓度为0.1952mol/L,平衡常数K的计算式为 ;
;
③增大容器体积,压强减小,平衡向气体体积增大的方向移动,即反应平衡向逆反应方向移动。
【2024甘肃等级考】18. 山药素-1是从山药根茎中提取的具有抗菌消炎活性的物质,它的一种合成方法如下图:

(1)化合物I的结构简式为_______。由化合物I制备化合物Ⅱ的反应与以下反应_______的反应类型相同。
A. B.
B.
C. D.
D.
(2)化合物Ⅲ的同分异构体中,同时满足下列条件的有_______种。
①含有苯环且苯环上的一溴代物只有一种;
②能与新制Cu(OH)2反应,生成砖红色沉淀;
③核磁共振氢谱显示有4组峰,峰面积之比为1:2:3:6。
(3)化合物IV的含氧官能团名称为_______。
(4)由化合物V制备VI时,生成的气体是_______。
(5)从官能团转化的角度解释化合物Ⅷ转化为山药素-1的过程中,先加碱后加酸的原因_______。
【答案】(1) ①.  ②. AD (2)6
②. AD (2)6
(3)酚羟基、醚键、醛基 (4)CO2
(5)提高化合物Ⅷ的转化率
【解析】
【分析】I的分子式为C9H12O2,在光照的条件下和氯气发生取代反应得II ,故I的结构为
,故I的结构为 ;化合物V转化为化合物VI发生脱羧反应,有CO2生成;
;化合物V转化为化合物VI发生脱羧反应,有CO2生成;
【小问1详解】
由分析,I的结构简式为 ,由化合物I制备化合物Ⅱ的反应类型为取代反应,A、D都是烃与氯气发生取代反应,B是苯在光照条件下和氯气发生加成反应,C是C2H4Cl2发生消去反应,故选AD;
,由化合物I制备化合物Ⅱ的反应类型为取代反应,A、D都是烃与氯气发生取代反应,B是苯在光照条件下和氯气发生加成反应,C是C2H4Cl2发生消去反应,故选AD;
【小问2详解】
化合物Ⅲ为 ,分子式C10H12O4,同时满足下列条件:①含有苯环且苯环上的一溴代物只有一种,说明苯环上只有一种化学环境的氢原子;②能与新制Cu(OH)2反应,生成砖红色沉淀,说明有醛基,根据分子式,不饱和度为5,除去苯环的不饱和度,只有一个醛基;③核磁共振氢谱显示有4组峰,峰面积之比为1:2:3:6,说明分子中有4种不同化学环境的氢原子,数目分别为1、2、3、6,故满足条件的同分异构体有:
,分子式C10H12O4,同时满足下列条件:①含有苯环且苯环上的一溴代物只有一种,说明苯环上只有一种化学环境的氢原子;②能与新制Cu(OH)2反应,生成砖红色沉淀,说明有醛基,根据分子式,不饱和度为5,除去苯环的不饱和度,只有一个醛基;③核磁共振氢谱显示有4组峰,峰面积之比为1:2:3:6,说明分子中有4种不同化学环境的氢原子,数目分别为1、2、3、6,故满足条件的同分异构体有: 、
、 、
、 、
、 、
、 、
、 ,共6种;
,共6种;
【小问3详解】
化合物IV的结构为 ,其中含氧官能团的名称为酚羟基、醚键、醛基;
,其中含氧官能团的名称为酚羟基、醚键、醛基;
【小问4详解】
对比化合物V和化合物VI的结构,化合物VI比化合物V少一个碳原子两个氧原子,由化合物V制备VI时,生成的气体是CO2;
【小问5详解】
化合物Ⅷ转化为山药素-1的过程发生的是酯基水解,酯在碱性条件下水解更彻底,再加入酸将酚羟基的盐转化为酚羟基得目标产物山药素-1,若直接加酸,由于酯在酸性条件下的水解可逆,产率较低,故先加碱后加酸是为了提高化合物Ⅷ的转化率。

- 全部评论(0)




