物质结构理论的建立
时间:2016-01-30 14:38 来源:未知 作者:龙立球 点击: 次 所属专题: 物质结构理论
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1.原子的精细结构
在道尔顿时代,化学在实验科学上的条件和基础都比较差,无法深入到原子内部进行研究。因此,原子学说的拥护者认为原子只不过是一个浑圆的小球,也就是说,原子是没有结构的。
19世纪后半叶,在原子世界中发生了两件使科学界震惊的大事:一件是英国物理学家汤姆生发现了电子;另一件是贝克勒尔和居里夫妇发现了放射性。
汤姆生证明了电子是各种原子的共同组成部分,说明原子不再是不能分割的圆球,因为放射性的发现证明了原子能够放射出粒子。于是科学家们开始设想原子结构的模型。
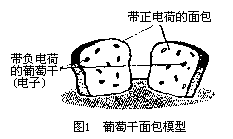
第一个提出原子结构模型的科学家是汤姆生。他发现了电子,而且证明电子是带负电荷的,由此推断出,原子中一定还有带正电荷的物质。于是,他提出了一种葡萄干面包模型。他把原子看成一个带正电的物体,并形象地把它看成是面包。在这个带正电的面包里散布着一些带负电荷的葡萄干,它们就是电子。最后,正电荷和负电荷正好互相抵消,形成中性的原子。
很显然,汤姆生的葡萄干面包模型缺少实验根据,而他的学生卢瑟福的技艺看来比老师高明。卢瑟福首先想到的是,确定原子的结构必须要有实验根据,要了解原子内部的情况,最好想办法把原子炸开。
卢瑟福做了α质点散射实验,让一束由镭产生的α质点撞击金箔。他发现,大多数α质点穿过金箔继续向前行进。但是,也有一部分α质点发生散射现象,即改变了原来的途径。一般说来,它们偏离原来前进的方向的角度不大。只有极少数的α质点(8000~10000个α质点中只有1个)偏转得特别厉害,好像碰到了坚硬的不可穿透的物体而被反弹回来。
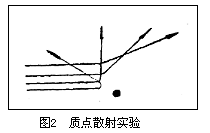
α质点有较大的质量,并带2个正电荷,它以每秒2×107m的极高的速度射出,只有它在行进中遇到集中在很小的体积内,并有较大的质量和正电荷的障碍物时,才有可能被弹回。卢瑟福认为,这个带正电荷的障碍物不是别的,正是原子核。另外,大部分α质点能够穿过金箔而不发生散射,证明原子内部有很大的空隙。
综合以上实验结果,通过周密的分析和推理,卢瑟福在1911年提出行星系式原子模型:“在原子的中心有一个带正电荷的核,它的质量几乎等于原子的全部质量,电子在它的周围沿着不同的轨道运转,就像行星环绕太阳运转一样。电子在运转时产生的离心力跟原子核对电子的吸引力达到平衡,因此电子能够跟原子核保持一定的距离,正像行星和太阳保持一定的距离一样。”
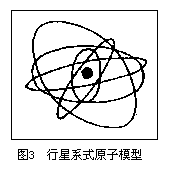
行星系式原子模型对于人们认识原子结构具有十分重要的意义。在科学的历史上,它第一次打开了原子的神秘大门。但是,这个模型还存在着一系列有待解决的问题。例如,根据这个模型,电子围绕原子核运动时必定要放出辐射能。电子的能量将越来越小,离原子核也会愈来愈近,最后,电子会堕入原子核中,而使整个原子毁灭。但是,事实证明原子是能长期存在的。
卢瑟福的学生,丹麦物理学家玻尔认为,原子世界中出现的问题已经不是经典物理学所能解决的。因此,他把卢瑟福的行星系式原子模型跟量子理论结合起来,提出了壳层模型。这个模型的要点为:①电子不能在原子核外的无数的一切可能的轨道上运行,而只能在某些特定的轨道上。这些轨道应该符合量子理论推导出来的条件,在一定的轨道上运行的电子具有一定的能量,这时原子所处的状态称为稳定状态。因此,电子运行的轨道可以比作运动场看台上的台阶,是一层一层的。②当一个电子被移走以后,这个电子的位置可以被外层电子顶替。外层电子进入内层轨道时会产生光谱线,并释放出能量。原子从一个稳定状态过渡到另一个稳定状态不是连续方式的,而要符合量子理论的条件。玻尔的壳层模型解决了行星系式原子模型存在的缺点,简单明了地描绘了原子结构。
汤姆生、卢瑟福和玻尔是三代师生关系。纵观这三位科学家的科学活动,不难发现他们最大的特点是虽然继承了老师的研究成果,但又不停留在老师的水平上,而是不断地进取,有所创新。用中国的一句名言“青出于蓝而胜于蓝”来描绘这三代科学家,真是再贴切也没有了。
2.原子之间是怎样化合的
在自然界,物质大部分由化合物组成,因此,化学家更关心的是原子与原子是怎样化合成为化合物的,也就是化合时是否遵循什么规律。经过化学家不懈地努力,终于发现,原子化合主要遵循两种理论,即电价理论和共价理论。
电价理论是由德国物理学家柯塞尔提出的。他认为,原子在获得(或失去)电子以后,就达到了稀有气体的电子结构,即最外层电子数达到8个,这是一种稳定的结构。
金属元素容易失去电子成为带正电的阳离子;非金属元素则容易获得电子成为带负电的阴离子,这时,阳离子和阴离子的最外层电子都达到8个,处于稳定状态。带正电的阳离子和带负电的阴离子靠库仑引力(静电吸引力)相结合,成为化合物。例如钠是金属元素,失去1个电子成为带正电的钠离子;氯是非金属元素,能获得1个电子成为带负电的氯离子,于是,带正电的钠离子和带负电的氯离子靠库仑引力吸引,结合为氯化钠,这种化合物被称为离子化合物。
提出共价理论的是路易斯,他是美国著名的大学加州大学伯克利分校化学系教授,曾获1961年诺贝尔化学奖。他认为,两个原子可以共有一对电子,也能使每个原子都达到最外层电子数为8个的结构,从而使形成的分子也能达到稳定状态。
氟原子的最外层电子为7个,在由两个氟原子结合成氟分子的过程中,有两个电子为两个氟原子所共有,结果每个氟原子的最外层电子数也都是8个,达到了稳定状态:
![]()
不同的原子也可以通过共有一对电子,形成稳定的结构,这样结合起来的化合物称为共价化合物。例如氢原子和氟原子通过共有一对电子,形成氟化氢,它就是共价化合物。
3.物质的晶体状态
人们认识晶体是从它们有规则的外形开始的。晶体的外形千姿百态、瑰丽多彩,而且晶体的外形往往是一种有规则的几何形状。例如我国宋代程大昌撰写的《演繁露》一书中就写道:“盐已成卤水,曝烈日中,即成方印,洁白可爱,初小渐大,或数十印累累相连。”食盐(氯化钠)晶体的几何外形是立方体,就是程大昌描写的“方印”。
法国结晶学家阿羽伊发现,把具有菱面体几何外形的方解石晶体摔碎,被摔成的小方解石晶体的晶面仍然是光滑平整的,而且都有相同的几何外形。于是,阿羽伊得出一个推论,如果把方解石晶体继续劈裂下去,最后可以得到一种单元,大小不同的方解石晶体就是由这种单元构成的。同样,食盐(氯化纳)可以是一个不小的立方体晶体,但它却是无数个小立方体构成的。
德国慕尼黑大学教授劳厄设想,让X射线穿过晶体结构,就应该产生衍射现象,可以把晶体中的空间结构描绘出来,这就是测定晶体结构的X射线衍射法的根据。
根据X射线衍射实验的测定结果,氯化纳晶体中,钠离子和氯离子有规则地周期性地排列着。每个钠离子的周围被带相反电荷的氯离子包围;而每个氯离子的周围同样被带相反电荷的钠离子包围,最后形成了可以有无限大的氯化钠晶体。这种晶体称为离子晶体。
在金刚石和石墨的结构中,有规则和周期性地排列着的碳原子,可以形成一个无限大的金刚石或石墨分子,这种晶体称为原子晶体。
各种金属也是一种晶体,有规则和周期性地排列着的金属原子所形成的晶体称为金属晶体。
晶体结构是研究物质内部原子、离子等在空间排列情况的蓝图,它使化学家和物理学家更深入地了解物质的结构和性能之间的关系,为很好地利用自然界的矿物以及合成新的材料提供了可靠的线索。

- 全部评论(0)
