实验探究:NO2能否用浓硫酸干燥?
时间:2015-05-24 17:51 来源:未知 作者:向小平 点击:次 所属专题: 浓硫酸 二氧化氮
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
二氧化氮为红棕色、有强烈刺激性气味、有毒性的气体。易溶于水,且能与水反应的一种酸性氧化物。在实验室制取NO2时,能否用浓H2SO4来干燥NO2气体,一般化学参考资料都没有明确指出,大学教材中的有关内容也是如此。但是目前在一些权威性著作中出现“浓硫酸可以用来干燥NO2气体”。在一些高中化学复习资料中,用浓硫酸来干燥NO2的练习和测试题频频出现。然而,这是一个十分明显的科学性错误。下面笔者就先用2个实验的客观现象来说明浓硫酸不能用于干燥二氧化氮气体。
1 实验一
1.1 实验装置如图1所示
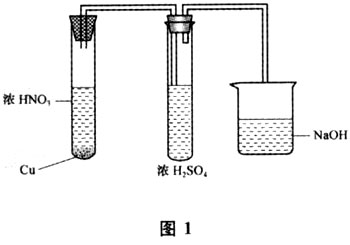
1.2 实验步骤
在1支带有导管的试管中用铜和浓硝酸反应制取的NO2气体,并且控制气流慢慢地通入到盛有大约2 mL 浓硫酸的试管里,将产生的尾气再通入到盛有NaOH溶液的烧杯中进行吸收处理,防止污染空气,然后仔细观察实验的现象。
1.3 实验现象及结果
(1)实验起初,通入到浓H2SO4中浓烈的红棕色NO2气流经过浓硫酸时,我们发现红棕色的气体竟然是有进无出!没有一点气体外逸。
(2)在短时间内浓硫酸吸收NO2后,无色透明的浓硫酸没有颜色变化,大约经过2 min,吸收了更多的NO2,浓硫酸才显浅红棕色。如果继续通入NO2气体,浓硫酸混合溶液的颜色才逐渐加深。
(3)在浅红棕色的浓硫酸混合溶液中加入一小块铜片,很明显的观察到铜片被溶解了。
(4)再把吸收了NO2的浅红棕色浓硫酸混合溶液在酒精灯上加热,混合溶液还没有达到沸腾以前,就会有大量被浓硫酸溶解的NO2解吸出来,并且很清楚地看到一些气体从溶液中向外逸出。
由此说明,NO2这种酸性氧化物能够溶解于浓硫酸。
2 实验二
2.1 实验装置如图2所示
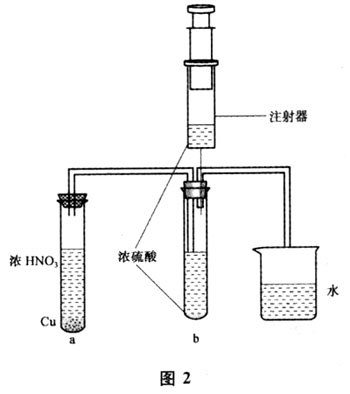
2.2 实验步骤及现象
向一充满红棕色NO2气体的试管b中用注射器注入2 mL 浓硫酸,可以明显地观察到注入浓硫酸之后,气体的红棕色迅速消失,浓硫酸混合溶液起初变成浅红棕色的液体,随着二氧化氮气体量的增加,无色透明浓硫酸混合溶液变为红棕色透明液体,实验的现象非常显著。
3 分析与结论
综上所述,2个实验证明浓硫酸不能用来干燥二氧化氮气体。大学教材中明确指出,在通常情况下,二氧化氮和四氧化二氮是一种混合物,不可能有纯净的二氧化氮气体,二氧化氮和四氧化二氮的混合物之所以能被浓硫酸强烈吸收,主要是基于以下几个方面的原因:
(1)物理吸收。NO2、NO、N2O4等等以分子的形式溶解在浓硫酸中,如果吸收了比较多的二氧化氮时,使得无色透明的浓硫酸呈明显的浅红棕色透明的液体。?
(2)NO2的化学吸收。二氧化氮与浓硫酸反应生成了亚硝基硫酸(NOHSO4)。化学反应方程式为:
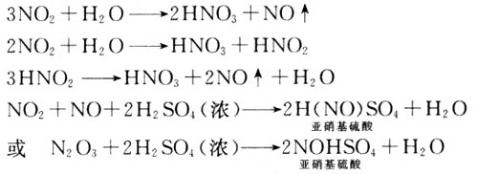
亚硝基硫酸在水中、酸中、空气中时会自发地分解释放出NO和NO2气体。
(3)N2O4的化学吸收。在室温下,NO2和N2O4是一种混合物,在反应平衡混合物中NO2仅占气体总体积的1/5不足,而N2O4气体却占4/5有余,那么,把NO2充入到浓硫酸中,浓硫酸中含有水,水和N2O4反应。
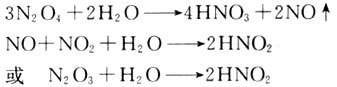
上述实验充分说明了浓硫酸不能用于干燥NO2气体。

- 全部评论(0)
(2182699521) 评论 实验探究:NO2能否用浓硫:大佬,早期的大佬
