有机化学中的定量关系
时间:2020-03-05 13:30 来源: 作者:向小平 点击: 次 所属专题: 有机反应定量关系
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
有机化学的学习除了抓住有机物的官能团及有机物之间转化的定性关系外,还要善于发现有机化学中的定量关系,并能定性与定量相结合,将有利于学好有机化学。
一、有机结构中的定量关系
1.用烃的相对分子质量除以14(CH2的式量),看商数和余数。
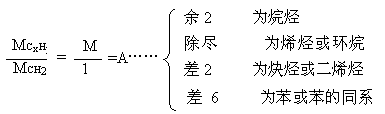
其中商数A为烃分子中碳原子的个数。
2.烯烃、环烷烃通式为,C、H质量比为定值,C%为定值:85.7%。
3.所有烃中,C的质量分数最小的CH4为(75%),其次为C2H6(80%)。
4.常温下为气态的烃,则C原子数一般小于等于4。
5.所有烃中C原子数为1的只有CH4,相对分子质量最小的也为CH4,其次为C2H2(式量26)。
6.符合一定碳、氢之比的有机物
(1)C∶H=1∶1的有:乙炔、苯、苯乙烯、苯酚等;
(2)C∶H=1∶2的有:甲醛、乙酸、甲酸甲酯、葡萄糖、果糖、单烯烃、环烷烃等;
(3)C∶H=1∶4的有:甲烷、甲醇、尿素等。
7.不同有机物若式量相同,则:
(1)、若少1个碳原子,则增加12个氢原子。
(2)、若少1个碳原子,4个氢原子,则增加1个氧原子。
(3)、若少4个碳原子,则增加3个氧原子。
8.互为同系物的有机物式量相差14N,碳原子数相同的烷烃与饱和一元醛,饱和一元醇与饱和一元羧酸(或酯)式量相差14。
9.常见的烃基结构:甲基、乙基均只有一种结构,丙基有2种结构,丁基有4种结构,戊基有8种结构。
10.烃或烃的含氧衍生物中H原子数最多为2N+2,若结构中有一个双键(包括碳氧双键)或一个环则少2个氢原子;若有一个碳碳三键则少4个氢;若有一个苯环则少8个氢。
11.饱和一元酸比饱和一元醇多1个碳原子时,两者的相对分子质量相等。
12.常见基团的式量:―CH3(15),―CH2―(14),―C2H5―(29),―C3H7(43),―C4H9(57),一价―C6H5―(77),二价―C6H4―(76),―CHO(29),―COOH(45),―OH(17),―NH2(16)。
二、有机反应中的定量关系
1、不饱和烃与氢气或卤素加成时,碳碳双键与氢气或卤素单质的物质的量之比为1∶1;碳碳三键与氢气或卤素单质的物质的量之比为1∶2;一个苯环与氢气加成时,其物质的量之比为1∶3。醛和酮中的碳氧化双键与氢气加成时的物质的量比为1∶1。注意:中学化学中一般不研究苯环与卤素的加成,羧基及酯基中碳氧双键与氢气的加成。
2、烷烃或芳香烃与卤素的一卤代反应中,被取代的氢原子、卤素单质、生成的卤化氢之间的物质的量之比为1∶1∶1。
3、醇与金属钠反应时,醇羟基、反应的钠、生成的氢气之间的物质的量之比为2∶2∶1,即2 ―OH →H2。
4、醛的银镜反应中,醛基与生成的银的物质的量之比为1∶2,即―CHO →2Ag。
5、醛与新制氢氧化铜反应中,醛基、消耗Cu(OH)2、生成的羧基、Cu2O的物质的量之比为1∶2∶1∶1,即―CHO →2Cu(OH)2。
6、羧基、酚羟基具有与NaOH反应的物质的量之比为1∶1。注意:酯基及卤代烃水解后生成的酸,也可与NaOH溶液反应,故酯基(或一卤代烃)与NaOH的物质的量之比为1∶1;若酯水解后另一产物为酚,则酚羟基与还能消耗NaOH。
7、酚与浓溴水反应时,在酚羟基的邻、对位发生取代,若其邻、对位均有氢,则酚羟基与Br2的物质的量之比为1∶3。
8、当醇被氧化生成醛时后,一个羟基氧化后式量减少2;醛被氧化生成羧酸后,一个醛基加氧化后变为羧基,式量增加16。如:
CH3CH2OH![]() CH3CHO
CH3CHO![]() CH3COOH
CH3COOH
(式量46) (式量44)(式量60)
即有一个—CH2OH最终氧化为—COH式量增大14。
9、酯化反应中的规律:
(1)当一元羧酸与一元醇完全酯化时,羧酸、醇、酯三者之间有如下关系:碳原子数n(酯)=n(酸)n(醇);②、氢原子数n(酯)n(酸)n(醇)-2;③、相对分子质量关系m(酯)=m(酸)+m(醇)-m(水)。
(2)、由反应CH3COOH(式量60)+C2H5OH(式量46) →CH3COOC2H5(式量88)+H2O(式量18)分析:
①、当一元醇与乙酸发生酯化反应生成酯后,酯的式量比一元醇的式量增加42,进一步可推导出,n元醇与乙酸发生酯化反应,酯的式量比n元醇的式量增加)42n。
②、当一元羧酸与乙醇发生酯化反应生成酯后,酯的式量比一元羧酸的式量增加28,同理可推导出,n元羧酸与乙醇发生酯化反应,酯的式量比n元羧酸的式量增加)28n。
三、有机物燃烧中的定量规律
1.气态烃( CxHy)在100℃以上温度完全燃烧时气体体积变化与C原子数无关,只与H原子个数有关,其规律如下:
① 若y=4,燃烧前后体积不变,ΔV=0
② 若Y>4,燃烧前后体积增大,ΔV=![]() —1
—1
③ 若Y<4,燃烧前后体积减少,ΔV=1—![]()
2 .气态烃( CxHy)完全燃烧后恢复到常温常压时气体体积的变化直接用烃类物质燃烧的通式通过差量法确定,气体体积总是减小,减小值为(1+![]() ),也只与H原子数有关。
),也只与H原子数有关。
3.液态有机物(大多数烃的衍生物及碳原子数大于4的烃)的燃烧,如果燃烧后水为液态,则燃烧前后气体体积的变化为:氢原子的耗氧量减去有机物本身提供的氧原子数的![]() 。
。
4、有机物(设其分子式为CxHyOz,下同),完全燃烧产物为CO2和H2O ,故可采用从燃烧产物逆向思考是解决此类题的有效方法。
如:①若CO2的体积比H2O少1,则y=2x+2,为烷烃、饱和醇、醚等;
②若CO2的体积等于H2O的体积,则y=2x,为烯烃、环烷烃、饱和一元醛、酸、酯等;
③若CO2的体积比H2O多1,则y=2x-2,炔烃、二烯烃等;
④若CO2的体积比H2O多3,则y=2x-6,为苯及其同系物。
5、有机物的物质的量一定时:
比较判断耗氧量的方法步聚:①烃类根据分子中碳、氢原子个数求(X+![]() )的值,(X+
)的值,(X+![]() )的值越大,耗氧量越多。也可以按1个碳原子与4个氢原子的耗氧量相当转换成碳或氢原子个数相同后再进行比较即可。②若属于烃的含氧衍生物,先将分子中的氧原子结合氢或碳改写成H2O或CO2的形式,即将含氧衍生物改写为 CxHy·(H2O)n或 CxHy·(CO2)m或 CxHy·(H2O)n·(CO2)m形式,再按①比较CHy的耗氧量。
)的值越大,耗氧量越多。也可以按1个碳原子与4个氢原子的耗氧量相当转换成碳或氢原子个数相同后再进行比较即可。②若属于烃的含氧衍生物,先将分子中的氧原子结合氢或碳改写成H2O或CO2的形式,即将含氧衍生物改写为 CxHy·(H2O)n或 CxHy·(CO2)m或 CxHy·(H2O)n·(CO2)m形式,再按①比较CHy的耗氧量。
6、有机物的质量一定时:
(1)烃类( CxHy)完全燃烧的耗氧量与![]() 成正比 (2)燃烧时耗氧量相同,则两者的关系为:(1)同分异构体 或 (2)最简式相同
成正比 (2)燃烧时耗氧量相同,则两者的关系为:(1)同分异构体 或 (2)最简式相同
1、混合物的总物质的量一定
(1)若生成的CO2为定值,则要求混合物中各组分化学式中C原子数应相同,如C2H6、C2H4和C2H6O。
(2)若生成的H2O为定值,则要求混合物中各组分化学式中H原子数应相同,如C2H6、C4H6和C2H6O2。
(3)若耗氧量为定值,要求各组分耗氧量相同,如C2H4、C2H6O等,一般通式如CHy和 CxHy·(H2O)m·(CO2)n。
2、混合物总质量一定
(1)若生成的CO2为定值,则要求各组分的c%相等,有两种情况:
①最简式相同,如C2H2和C6H6,HCHO和CH3COOH,通式为CnH2n的烃。
②最简式不同,如CH4与C8H16O、C9H20O及C10H8O2等,
此类有机物的特征是,c%不变,将H质量与O质量进行等量代换,即16H~O,如CH4![]() C8H32(8CH4)
C8H32(8CH4)![]() C8H16O
C8H16O
(2)若生成的H2O为定值,则要求各组分的h%相等,有两种情况:
①最简式相同,如C2H2和C6H6,HCHO和CH3COOH,通式为CnH2n的烃。
②最简式不同,如C7H8和C3H8O3,处理方法同上
(3)若耗氧量为定值,则要求C%、H%都相同,即有机物的最简式相同。

- 全部评论(0)
