可燃冰与包合物
时间:2016-03-13 00:01 来源:未知 作者:陈丽娟 点击: 次 所属专题: 可燃冰
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
可燃“冰”是一种沉睡海底和髙寒冻土地带的一 种独特新能源。提取可燃“冰”,不能不提到前苏联天然气专家契尔斯基在劳动场地那扣人心弦的一 幕。事件的经过是这样的:当时他正在指导工人把 水注入天然气井中,看对产气量有何影响,结果一件意外的事件发生了。当他叫工人向一口正在出气的气井中注入20 t水后,气井突然变得沉寂了,从此不 再出气。人们都抱怨契尔斯基把一口好端端的气井 给断送了。
为什么向气井中注水气井就断气呢?有 没有挽救的办法?契尔斯基在沉思,突然一个灵感 闪现在他的心头,他果断地做出了大胆的决定,他命令工人向井里注人2 t甲醇。不一会奇迹出现了,气 井又复活了,大量的可燃气体源源不断地向外冒。 大家欢呼雀跃,都称赞契尔斯基是一位足智多谋的 专家。那么气井先断气后又出气的原因何在?促使他进一步深人思考。经研究发现,许多气体在低 温和髙压下都容易形成水合物。在气井深处,矿层压力大,温度低(地处西伯利亚),因此,当人们向气井注人水后,水和气体迅速结合形成水合物,相互冰冻在一起,气井就不冒气了,注人甲醇后,甲醇跟水有很大的亲和力,形成异分子间氢键,既破坏了水合 物的结构,又降低了冰点,可燃气被解放出来,重新冒气了。
契尔斯基前后的措施给科学家以启示:按照水合物形成条件推算,自然界中应该存在水合物宝藏。高寒冻土地带、海底存在气体水合物的可能 性很大。从此,自然界天然水合物研究进人科学家 的研究视野。从20世纪60年代开始,科学家敏锐地把注意力投向自然界可能存在的天然气水合物及其诱人的资源前景上,一直密切关注和探索永久冻 土地带和海底世界是否存在天然气水合物,即可燃 “冰”的存在。经过化学家和地质学家们的共同努 力,终于在北极海底发现了大量的可燃“冰”。苏、美 科学家经过一系列的论证,地下存在天然气水合物 的理论著作相继问世。科学家研究发现,海洋底部 是天然气水合物矿藏形成的最佳场所,海洋底部总面积的90%具有形成天然气水合物所需的温度和 压力条件。据推算,其储存量竟比煤、石油的储存量 大百倍以上。这可是个令人鼓舞的数字,无疑是给人类注入了一剂兴奋剂。
可燃“冰”是怎样形成的呢?迄今还是个谜。众 说纷纭,莫衷一是。据科学家初步分析认为,由于海底水温低,压力大,海洋生物和微生物死亡,尸体沉 人海底,在无氧环境下,经过厌氧菌分解,生成甲烷、 乙烷等可燃气体,然后钻人海底疏松的沉积岩,与水 结合成可燃“冰”。年复一年,在海底就形成了绵延 数万里的可燃“冰”的矿藏。
可燃“冰”的储存大,含能量高,人类将如何开发它?契尔斯基破冰有术,然而用甲醇去破海底的冰显然是不切实际的。如何开采海底这样巨大的 能源宝藏,是摆在科学家面前的一大科学难题。
科学家断言,天然气水合物作为未来的一种潜在能源将独具魅力。可以预见,在不久的将来,天然 气水合物将成为我们生活的一部分。我国在研究开 发可燃“冰”方面起步较晚。目前我国科技工作者既 关注着国际上天然气水合物研究的进展情况,又着 手研究开发我国靑藏高原和广大近海所蕴藏的天然 气水合物。科学家认为,我国广大海域和永冻地域 具有天然气水合物良好的发育环境和条件;作为替 代能源,对我国社会经济发展和国家安全具有重要 的战略价值。我国加人WTO后国际竞争的压力更 大,以及能源储备和能源结构在政治、经济、安全等 重大战略影响,无疑使天然气水合物研究成为极具前瞻性和战略性的重大课题。最近,英国科学家利 用天然气作为燃料电池还原气,已经获得成功,为人 类合理开发利用新能源迈出了可喜的一步。
可燃“冰”也成为近年来化学竞赛和高考命题的热点,并编人新版高中化学教材的练习中。本文想 通过2000年全国化学初赛的11题,谈谈包合物的结构问题。该题要意是:已经探明,我国南海跟世界 上许多海域一样,海底有极其丰富的甲烷资源。其总量超过已知蕴藏在我国内陆地下的天然气总量的 一半。据报道,这些蕴藏海底的甲烷是高压下形成 的固体,是外观像冰的甲烷水合物。试设想,若把它 从海底取出,拿到地面上,它将有什么变化?为什 么?它的晶体是分子晶体、离子晶体、还是原子晶 体?你做出判断的根据是什么?已知每1 m3这种 晶体能释放出164 m3的甲烷气体,试估算晶体中水与甲烷的分子比。
简答:从海底取出的甲烷水合物将融化并放出甲烷气体。因为该晶体是分子晶体,甲烷分子和水 分子都是由有限数目的原子以共价键结合的小分 子,水分子和甲烷分子之间是范德华力,而水分子之 间是范德华力和氢键,都是弱的作用力。假设甲烷 气体体积已折算成标准状况下的数据,那么甲烷气 物质的最为:164 m3÷ 22.4 m3/kmol=7.32 kmol。设 甲烷水合物的密度与冰的密度相同,即1 g/cm3,那 么水分子与甲烷的分子数之比约为:
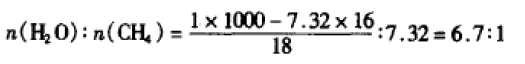
由于可燃冰沉人海底,密度会大增,另外甲烷的 密度肯定比水小,合理的答案应是 n(CH4):n(H2O)>6.7:1。理论推箅甲烷水合物的组成可能是 8CH4·46H2O。所以参考答案应为n(CH4):n(H2O)> =7~9:1
甲烷类的中性分子生成的水合物是一类广泛存 在的包合物。这种类型化合物的极限式是8X·46H2O,式中X可以是Ar、Kr、Xe、Cl2、CH4等等。它 们的基本结构单元是由20个水分子组成的12面体
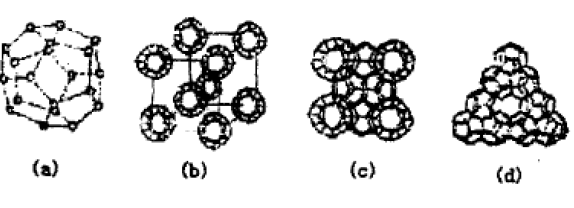
如图a,在20个顶点上各放1个H2O分子,每个水分子通过氢键同其他3个水分子相连接,这里的氢键就构成了多面体的边,这种正五边形的每个键角 都是108°,和四面体的键角109.5极为接近,很适合水分子之间形成氢键。有半数氧原子的第四个配位位置由氢原子占据,再同相邻的多面体以氢键相连, 另一半氧原子的第四位位置上各有一对孤电子对, 它们从邻近的多面体或单体水接受氢键。把这种正 十二面体作为构成晶体的基本单位,相互间以氢键 的方式形成更大的多面体。多面体堆积在一起形成 大的单位时,在结构中形成了相当大的孔穴,孔穴的 空间可以容纳客体大分子X,X与水之间并非化学键,而是被宿主以范德华力包藏在结构里,因而把它 们叫做包合物(也有的书上叫笼形化合物)。简而言 之,以20个水分子构成的正十二面体为单位,构成 体心立方晶胞,在晶胞中包含了 2个完整的十二面 体,其中一个占据立方体的8个顶点,另一个占据立 方体的体心位置,构成图b。在立方体的6个面心 各有一个水分子,用氢键与正十二面体中的相关氧相连,面心水与顶点笼、体心笼把立方体分割为8个 孔穴,如图C。这样可燃“冰”晶胞最多可以宿住8 客体分子,构成极限式8CH4·46H2O。
其实包合物,也叫溶剂笼状物。溶剂状物晶体 结构,上面只是简单的一种,还有更复杂的像金字塔 似的结构。如HCC13的水合物能形成另一种的立方 晶体,在晶体内有大小不等的2类笼,按一定的比例 搭配,形金大小不等的2类空穴,供客体分子宿住。 见图d。
溶剂笼状物在研究反应机理中也得到了证明。 像偶氮烷、过氧化物等游离基反应的产物产率百分比很能说明这个问题。例如:偶氮甲烷和全氘甲烷 的混合物在气相中光解时,形成的游离基•CH3和•CD3迅速随机重组结合生成产物:n(CH3CH3): n(CD3CD3):n(CH3CD3) = l:1:2。如果当该反应在 惰性溶剂异辛烷中重复该反应时,和N2 —起形成CH3CH3和CD3CD3,没有发现CD3CH3的存在。这一 现象的合理解释就是:溶剂分子使甲基游离基从母体分子形成后仍保持在一起(在溶剂笼内),直到它们重新结合为止。其图解为:
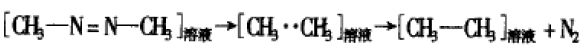

- 全部评论(0)
