浅析可充电电池
时间:2020-03-13 09:10 来源:未知 作者:陈功健 点击: 次 所属专题: 二次电池
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
可充电电池是联系原电池和电解池的桥梁,它 是电化学知识的重要知识点,是学生学习的重点和难点。为了让学生比较透彻地掌握这方面知识,笔 者对此总结如下,供同学们参考。
1、有关可充电电池的基础知识
(1) 可充电电池属于可逆电池,但不是可逆反 应,因为两个反应的条件不同。
(2) 可充电电池有充电和放电两个过程,放电为 原电池反应,充电为电解池反应,
(3) 可充电电池的电极材料
作正极(阴极)的电极材料不论是惰性电极(C、 Pt、Au等:)还是活泼电极,一般都不参与电池中的电 极反应;作负极(阳极)的电极材料除惰性电极外, 一般都参与电池中的电极反应。
(4) 可充电电池电极的判断
①从氧化还原反应角度判断
原电池的正负极判断:负极:失去电子的一极,发 生了氧化反应;正极:得到电子的一极,发生了还 原反应。电解池的阴阳.极判断:阴极:得到电子的 一极,发生了还原反应;阳极:失去电子的一极, 发生了氧化反应。
②从离子的移动方向判断
原电池的正负极判断:负极:阴离子移向的一 极;正极:阳离子移向的一极。
电解池的阴阳极判断:阴极:阳离子移向的一 极;阳极:阴离子移向的一极。
③从电子的流向判断
原电池的正负极判断:负极:电子流出的一 极:正极:电子流入的一极。
电解池的阴阳极判断:阴极:电子流入的一 极;阳极:电子流出的一极。
(5) 可充电电池电极反应式的书写应遵循的原则
无论原电池还是电解池,其电极反应都是氧化还原反应,电极反应式的书写应遵循质量守恒、电 子守恒及电荷守恒,还要看电极材料、电极的正 (阴)负(阳)极及电池中电解质的酸碱性。
(1) 可充电电池电极反应式的书写过程 书写可充电电池电极反应式,一般都是先书写放电的电极反应。先写出比较容易写的一个电极反 应,然后在电子守恒的基础上,总式减去该电极反 应式即得另一电极反应式。充电的电极反应与放电 的电极反应过程相反,即充电的阳极反应为放电正 极反应的逆过程,充电的阴极反应为放电负极反应 的逆过程。
(2) 充电时可充电电池与电源正负极相连的判断 充电时,原电池的负极与外电源的负极相连,原电池的正极与外电源的正极相连。
2、可充电电池的应用举例
解可充电电池的题目关键在于电极反应式的书 写,只要能顺利地写出电极反应,再具备上述电化 学的基本知识,即可正确回答可充电电池的有关问 题。
例1.某碱性蓄电池在充电和放电时发生的总反 放电应式为:Fe+NiO2+2H2O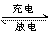 Fe(OH)2+Ni(OH)2,下 列说法正确的是( )
Fe(OH)2+Ni(OH)2,下 列说法正确的是( )
A. 电池放电时,NiO2极发生氧化反应;
B. 电池放电时,负极反应为:Fe-2e-=Fe2+;
C. 电池充电时,阳极反应为Ni(OH)2+2OH--2e- =NiO2+2H2O;
D. 电池充电时,铁元素被氧化。
解析:放电时是原电池反应,其反应为 Fe+NiO2+2H2O=Fe(OH)2+Ni(OH)2 铁为负极,失去电子,产物为Fe(OH)2, OH-参与负极反应;即负极电极反应为:Fe+2OH--2e-=Fe(0H)2; NiO2为正 极,得到电子,发生还原反应,其电极反应可由总式减去负极反应求得:NiO2+2H2O+2e- =Ni(OH)2+2OH-,充电时是电解池反应,阳极反应为正极反应的逆过程,阴极反应为负极反应的逆过 程。所以,阴极反应为:Fe(OH)2+2e-=Fe+2OH-, 阳极反应为:Ni(OH)2+2OH--2e-=NiO2+2H2O。答 案为C。 '
例2.据报道,摩托罗拉公司开发了一种以甲醇 为原料,以KOH为电解质的用于手机的可充电的高 效燃料电池,充一次电可连续使用一个月。关于该 电池的叙述正确是
A.放电时,正极反应为:O2+4e-+4H+=2H2O;
B. 放电时,负极反应为:CH3OH-6e-+8OH-=CO32-+6H2O;
C. 充电时,原电池的负极与电源正极相连;
D. 充电时,阴极反应为4OH--4e-=2H2O+O2。
解析:本题首先应写出反应总式,但应注意反应物能否与电解质溶液反应,若能反应,写出继续 反应的化学方程式,将两式相加,即得原电池总的化学方程式。
本题首先应写出总式,因为 2CH3OH+3O2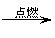 2CO2+4H2O, CO2+2KOH= K2CO3+H2O。所以该电池的总反应式为: 2CH3OH+3O2+4KOH =2K2CO3+6H2O。放电时为原电池反应,O2参与正极反应,由于是碱性电解 质,OH-参与负极反应,其正极反应为:O2+2H2O- 4e-=4OH-, CH3OH参与负极反应,其电极反应为总 式减去正极反应式(在电子守恒的基础上)可得: CH3OH+8OH--6e-=CO32- +6H2O,充电时 CH3OH负 极应接在电源负极上。充电时为电解池反应,按上 述基本知识可知,其阳极反应为4OH--4e- =2H2O+O2 ,阴极反应为 CO32-+6H2O+6e- =CH3OH+8OH-
2CO2+4H2O, CO2+2KOH= K2CO3+H2O。所以该电池的总反应式为: 2CH3OH+3O2+4KOH =2K2CO3+6H2O。放电时为原电池反应,O2参与正极反应,由于是碱性电解 质,OH-参与负极反应,其正极反应为:O2+2H2O- 4e-=4OH-, CH3OH参与负极反应,其电极反应为总 式减去正极反应式(在电子守恒的基础上)可得: CH3OH+8OH--6e-=CO32- +6H2O,充电时 CH3OH负 极应接在电源负极上。充电时为电解池反应,按上 述基本知识可知,其阳极反应为4OH--4e- =2H2O+O2 ,阴极反应为 CO32-+6H2O+6e- =CH3OH+8OH-
答案为B。

- 全部评论(0)
