粗盐提纯中的钡试剂可以选用Ba(0H)2吗?
时间:2016-03-21 21:15 来源:未知 作者:何立功 点击: 次 所属专题: 粗盐提纯
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
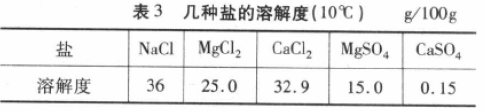
粗盐提纯即除去Ca2+、Mg2+、SO42-三种杂质 离子的过程,为了保证每种杂质离子被除尽,加人 的沉淀剂(Na2CO3、NaOH、BaCl2 )须过量,又为了 把沉淀剂带进来的新的杂质离子除去,还要考虑沉淀剂的加人顺序,所以,BaCl2 —定要在Na2CO3之前加入,至于NaOH的加入顺序则没有要求,故 3种沉淀剂的加人有3种顺序,而不是6种。三 步得到的沉淀可以最后一起过滤除去。
有学生提 出不妨将NaOH、BaCl2 二合一,即选用Ba(OH)2 ,以一顶两,起到一举两得的功效,一起将Mg2+、 SO42-两种离子除去。乍一看,没有什么问题,多数教师包括一些教学参考书上也认同这种作法。 这样做究竟好不好呢?
还是假设取1 kg 海水将水完全蒸发,由表1 知道,得到的固体中Mg2+ 1.28 g、SO42-2.66 g,计 算可得,Mg2+ 0. 0533 mol,SO42-0. 0277 mol,如果 选用NaOH、BaCl2作为沉淀剂,消耗的NaOH、 BaCl2 分别是 0. 1066 mol、0. 0277 mol,而用 Ba(0H)2作为沉淀剂需消耗0.0533 mol,但是, SO42-只需要消耗 Ba2+0.0277 mol,有0.0256 mol Ba2+剩余,那么,后续就要增加消耗0. 0256 mol 的Na2CO3。可见,选用Ba(OH)2作为沉淀剂并没有讨巧。
假如粗盐中Mg2+、SO42-物质的觉相等,那么选用Ba(OH)2作为沉淀剂可以同时将它 们除尽,无需过多增加Na2CO3的用量。当然,这 其中也涉及原料的价格因素,所以,实际生产中没 有采用Ba(OH)2来替代NaOH和BaCl2。
(责任编辑:化学自习室)

说点什么吧
- 全部评论(0)
还没有评论,快来抢沙发吧!
