无机化学工艺流程题解读
时间:2020-12-21 16:30 来源:未知 作者:张劲辉 点击:次 所属专题: 工艺流程题解题指导
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
近年来,无机化学工艺流程题风靡高考化学试卷,是高考化学试卷中一道不可或缺的试题,尤其是无机化学工艺流程题的命题情境与生活、生产紧密相连。
一、知己知彼,了解考查模型
工业流程题目在流程上一般分为三个过程:原料处理→分离提纯→获得产品
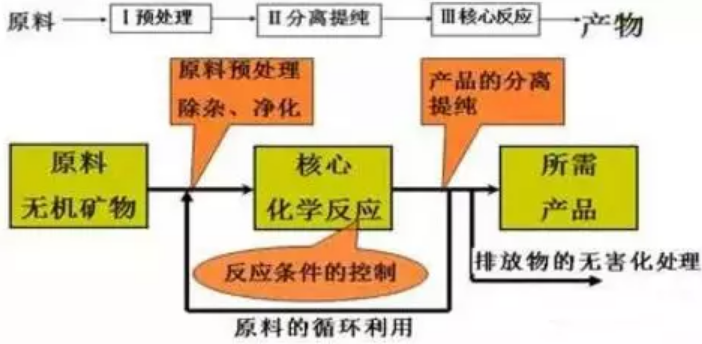
要点诠释:
规律:主线主产品,分支副产品,回头为循环。
核心考点:物质的分离操作、除杂试剂的选择、生成条件的控制等。
解读一:原料预处理方式

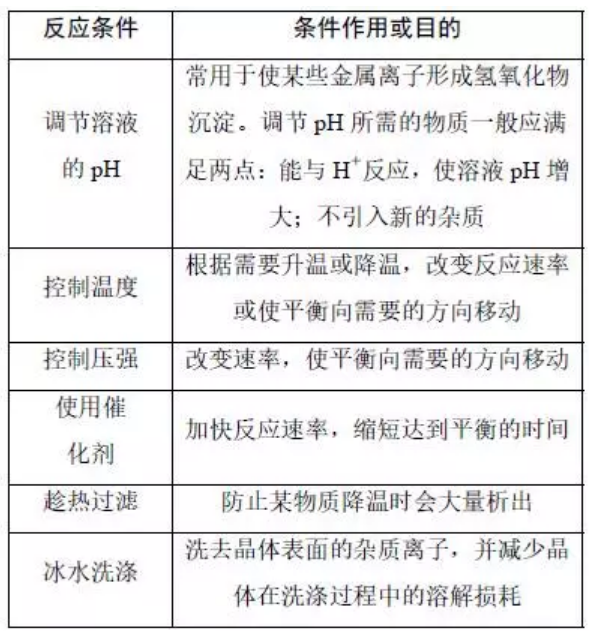
解读二:必考的反应条件
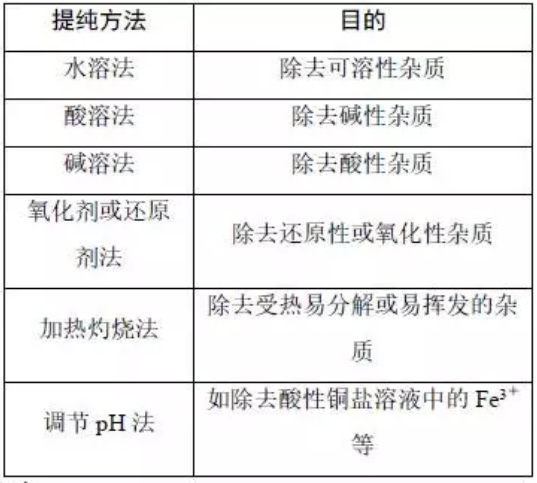
解读三:提纯方法
解读四:分离方法
(1)过滤:分离难溶物和易溶物,根据特殊需要采用趁热过滤或者抽滤等方法。
(2)萃取和分液:利用溶质在互不相溶的溶剂里的溶解度不同提取分离物质,如用CCl4或苯萃取溴水中的溴。
(3)蒸发结晶:提取溶解度随温度变化不大的溶质,如NaCl。
(4)冷却结晶:提取溶解度随温度变化较大的溶质、易水解的溶质或结晶水合物,如KNO3、FeCl3、CuCl2、CuSO4·5H2O、FeSO4·7H2O等。
(5)蒸馏或分馏:分离沸点不同且互溶的液体混合物,如分离乙醇和甘油。
(6)冷却法:利用气体易液化的特点分离气体,如合成氨工业采用冷却法分离氨气与氮气、氢气。
二、分析流程题需要的一般思路
1.解答流程题的一般思路是:
(1)浏览全题,确定该流程的目的,看懂生产流程图;
(2)了解流程图以外的文字描述、表格信息、后续设问中的提示性信息,并在下一步分析和解题中随时进行联系和调用;
(3)解析流程图并思考从原料到产品依次进行了什么反应,利用了什么原理。每一步操作进行到什么程度最佳,每一步除目标物质外还产生了什么杂质或副产物,杂质或副产物是怎样除去的等等。
要抓住一个关键点:一切反应或操作都是为获得产品而服务。
2.解答流程题要注意的问题是:
(1)注意化学方程式的书写,反应物、产物的分子式书写要正确;
(2)化学方程式要配平,电极反应式和化学方程式一定要书写正确;
(3)等号或可逆符号不能少;
(4)沉淀、气体、固态、水溶液等符号要标明。
(5)注意评价或比较实验方案要全面,反应物种类多少、是否易得、是否对环境有污染;
(6)反应产物的种类多少,对目标产物的分离和提纯是否有影响;
(7)反应条件是否苛刻;
(8)仪器、设备是否要求高;
(9)工艺流程、实验步骤的多少。注意描述语言的规范性和准确性,从化学原理的角度、用化学语言作答;
(10)要抓住主要问题,针对具体问题作具体分析;
(11)要看清题目要求,按要求答题。
【高考真题】
【2015·山东】(19分)毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:
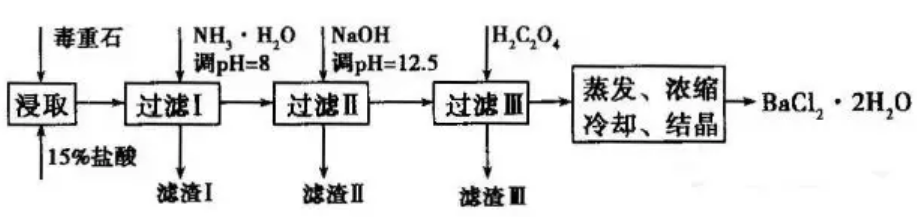
(1)毒重石用盐酸浸取前需充分研磨,目的是_____。实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的_____。
A.烧杯 B.容量瓶 C.玻璃棒 D.滴定管
(2)
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
加入NH3·H2O调节pH=8可除去_____(填离子符号),滤渣Ⅱ中含_____(填化学式)。加入H2C2O4时应避免过量,原因是______。已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
(3)利用简洁酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO42-+2H+=Cr2O72-+H2O
Ba2++CrO42-=BaCrO4↓
步骤Ⅰ:移取xmL一定浓度的Na2CrO4溶液与锥形瓶中,加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL。
步骤Ⅱ:移取y mL BaCl2溶液于锥形瓶中,加入x mL 与步骤Ⅰ 相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL。
滴加盐酸标准液时应用酸式滴定管,“0”刻度位于滴定管的_____(填“上方”或“下方”)。BaCl2溶液的浓度为______mol·L-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将______(填“偏大”或“偏小”)。
【答案】(1)增大接触面积从而使反应速率加快;AC
(2)Fe3+;Mg(OH)2、Ca(OH)2;H2C2O4过量会导致生成BaC2O4沉淀,产品的产量减少。
(3)上方;(V0b—V1b)/y;偏小。
【解析】(1)充分研磨可以增大反应物的接触面积,增大反应速率;因为配制的盐酸溶液浓度为质量分数,可以计算出浓盐酸的体积和水的体积,所以使用烧杯作为容器稀释,玻璃杯搅拌。
(2)根据流程图和表中数据,加入NH3•H2O调pH为8,只有Fe3+完全沉淀,故可除去Fe3+;加入NaOH调pH=12.5,Mg2+也完全沉淀,Ca2+部分沉淀,所以滤渣Ⅱ中含Mg(OH)2、Ca(OH)2;根据Ksp(BaC2O4)=1.6×10-7,H2C2O4过量时Ba2+转化为BaC2O4沉淀,BaCl2·2H2O产品的产量减少。
(3)“0”刻度位于滴定管的上方;与Ba2+反应的CrO42-的物质的量为(V0b—V1b)/1000mol,则Ba2+浓度为(V0b—V1b)/Y;根据计算式,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,V1减小,则Ba2+浓度测量值将偏大。。

- 全部评论(0)
