回归教材实验之课本实验及实验设计
时间:2020-05-28 17:36 来源:未知 作者:张劲辉 点击: 次 所属专题: 课本实验 回归教材实验
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
必修一:7个
P13探究在相同温度和压强下,1mol O2和H2的体积相同;P26探究Fe(OH)3胶体的制备和性质;
P48探究Al的热熔现象;P50设计实验探究Fe与水的反应;
P56探究Na2CO3和NaHCO3性质的异同点;P61探究Fe3+和Fe2+的转化;
P92探究NO2被水吸收的效率;
必修二:7个
P5探究碱金属Na与K的性质;P14探究短周期元素原子结构的递变;
P15探究第三周期元素性质的递变;P41探究原电池原理;
P61探究CH4与Cl2的光取代反应;P67探究石蜡油的催化裂化的产物;
P75探究醋酸和碳酸酸性的强弱;
选修四:6个
P21探究温度对I-被O2氧化的影响;P23探究催化剂对反应速率的影响;
P54探究盐溶液的酸碱性;P57探究影响Fe3+水解的条件;
P82探究电解饱和食盐水的实验;P87探究牺牲阳极的阴极保护法;
必修一
1.【P88课后习题13】请设计尽可能多的方法区分厨房中的食盐和碳酸钠?
1、答案:方法一:分别取2种白色粉末于2支试管中,各加入1mL 白醋,有气泡产生的是碳酸钠,无明显现象的是食盐;
方法二:分别取2种白色粉末于2支试管中,各加入少量水,用温度计测量粉末温度的变化,若温度升高的为碳酸钠,变化不明显的是食盐;
方法四:分别取2种白色粉末于2支试管中,各加入少量水(不要使固体溶解),若粉末变成块状的是碳酸钠,无明显现象的是食盐(原理:Na2CO3+10H2O= Na2CO3·10H2O)
方法五:分别取少量2种白色粉末于2支试管中,加入蒸馏水溶解,用pH试纸检验溶液的酸碱性,若溶液呈碱性的是碳酸钠,呈中性的是食盐。
2.【P92科学探究】现给你一试管NO2,请设计实验,尽可能多的用水吸收NO2?
实验步骤 | 现象 | 解释(可用化学方程式表示) | |
⑴ | 将一支充满NO2的试管倒放在盛有水的水槽中 | 红棕色气体逐渐消失,水位上升,最后水充满试管的3,上部3为无色气体 | 3NO2+H2O=2HNO3+NO NO2为红棕色气体,溶于水后生成无色的NO |
⑵ | 制取少量O2 | 2H2O22H2O+O2↑ | |
⑶ | 将O2缓慢缓慢通入⑴的试管中 | 无色气体变为红棕色,又逐渐变成无色,气体体积逐渐减小,液面上升 | 2NO+ O2= 2NO2 3NO2+H2O=2HNO3+NO |
3.【P104课后习题9】在三支试管中分别盛有稀硫酸、稀硝酸、稀盐酸,请设计简单的实验方案鉴别。
3、答案:分别取三种溶液于试管中,各加入几滴BaCl2溶液,有白色沉淀产生的是稀硫酸;再取剩余的2种溶液于2支试管中,加入几滴AgNO3溶液,有白色沉淀产生的是稀盐酸,剩余的是稀硝酸
4.【P104课后习题10】在2支试管中分别盛有相同体积的浓硫酸和稀硫酸,请设计简单的实验方案鉴别。
4、答案:方案一:分别取相同体积的两种溶液,用密度计测量溶液的密度(或称量质量),密度大的是浓硫酸;
方案二:分别取两种溶液于试管中,轻轻振荡试管,流动性差的、黏度大的是浓硫酸,黏度小的是稀硫酸;
方案三:在2个小烧杯中加入10mL 蒸馏水,分别缓慢加入2种溶液,放出大量热的是浓硫酸,放出热量小的是稀硫酸;
方案四:在2支试管中加入几粒蓝色硫酸铜晶体,再分别加入1mL2种溶液,若试管中蓝色晶体变色白色的是浓硫酸,晶体溶解且溶液变成蓝色的是稀硫酸;
方案五:分别将2片打磨干净的铁皮放在2支试管中,再分别加入2种溶液,有气泡产生的是稀硫酸,无明显现象的是浓硫酸;
方案六:分别用玻璃棒蘸取2种溶液涂在纸上,一段时间后,纸上涂液的地方变黑的是浓硫酸,无明显现象的是稀硫酸。
5.【P108课后习题13】请你用实验方法证明某种白色晶体是(NH4)2SO4。
5、答案:取少量晶体于试管中,加入少量蒸馏水溶解,再将溶液分成2份,一份中加入浓NaOH[或Ba(OH)2]溶液并加热,将润湿的红色石蕊试纸置于试管口,若试纸变成蓝色,证明该晶体中存在NH4+;向另一支试管中加入稀盐酸酸化,再加入几滴BaCl2溶液,若产生白色沉淀,证明该晶体中存在SO42-
必修二
6.【P34思考与交流】请设计实验来测定盐酸与NaOH溶液反应的中和热?
6、答案:将50mL0·50mol/L 盐酸溶液和50mL0·55 mol/L NaOH溶液混合,用温度计测量混合溶液温度的变化,利用计算该反应的中和热
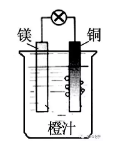
7.【P41科学探究】利用提供的实验用品,设计一套电池装置。
用品:镁条、铜片、铁皮、导线、金属夹、小灯泡、橙汁、500mL 烧杯。
画出实验装置图 | 实验用品及操作 | 实验现象 | 结论 |
| 实验用品:镁条、铜片、导线、金属夹、小灯泡、橙汁、500mL 烧杯。 操作:在烧杯中加入200mL 橙汁,再用导线将镁条、铜片和小灯泡连接后,将镁条、铜片插入烧杯的橙汁中; | 小灯泡变亮 铜片上有气泡产生 一段时间后Mg被腐蚀 | 该装置形成了原电池,产生了电能 |
8.【P57课后习题6】请设计实验来探究纯碱与盐酸反应制取CO2的适宜途径。
8、答案:取不同浓度的盐酸与纯碱粉末反应,若产生CO2气泡的速率适中,则该浓度的盐酸与纯碱粉末反应是制取CO2的适宜浓度。
9.【P75科学探究】设计一个比较醋酸与碳酸酸性强弱的实验。
9、答案:方案一:将0.1mol/L 的CH3COOH溶液加入到0.1mol/L 的Na2CO3或NaHCO3溶液中,产生大量气泡,说明草酸的酸性比碳酸强
方案二:分别测量0.1mol/L 的CH3COONa、NaHCO3溶液的pH,若NaHCO3溶液的pH大于CH3COONa,说明CH3COOH的酸性比碳酸强;
10.【P85课后习题】阿司匹林、去痛片等药片是用淀粉作为黏合材料压制而成的片剂,请设计实验来证明其中淀粉的存在。
10、答案:取一片药片,用研钵研细,将少量粉末置于试管中加入少量蒸馏水溶解,加入几滴碘水,若溶液变成蓝色,证明药片中存在淀粉;
11.【P91思考与交流】设计一个实验方案将海水中的Br-转变为Br2?
11、答案:向浓缩海水中通入Cl2,用空气将溶液中的Br2吹出后用SO2吸收富集,再加入Cl2氧化后蒸馏,即可得到Br2;
12.【P94课后习题9】孔雀石的主要成分是CuCO3·Cu(OH)2,将孔雀石粉粹后加入过量的稀硫酸后过滤,请设计另一种方案从滤液中获取金属铜?
12、答案:方法一:向滤液中加入足量NaOH溶液后过滤,干燥并灼烧,再用H2还原即可得到Cu
方法二:用石墨电极作阳极、铜电极作阴极电解滤液,也可得到金属铜
13.【P106课后习题7】煤干馏会产生H2S等有害气体,请设计一种方案将H2S转化为硫磺。
13、答案:将H2S气体用纯碱溶液吸收,H2S+Na2CO3=NaHS+ NaHCO3,向吸收液中加入H2O2(气体氧化剂也可)溶液氧化,过滤即可可得硫磺。
选修四
14.【P21科学探究】已知4H++4I-+O2=2I2+2H2O,现有1mol/L KI溶液、0.1mol/L H2SO4溶液和淀粉溶液,请设计实验探究出现蓝色的时间与温度的关系?
14、答:方案一:将1支试管置于冷水浴中,向试管中加入1mL 1mol/L KI溶液、2滴淀粉溶液,再迅速加入1mL 0.1mol/L H2SO4溶液,并同时用秒表记录试管中出现蓝色的时间。再将另一支试管置于热水浴中进行相同的实验,并记录出现蓝色的时间。若温度高时出现蓝色的时间短,说明温度高,该反应的反应速率快,反之则慢。
方案二:在2支试管中加入1mL 1mol/L KI溶液、2滴淀粉溶液,将一支试管置于5℃的冰水浴中,另一支试管置于50℃的热水浴中,同时迅速向2支试管中加入1mL 0.1mol/L H2SO4溶液,若温度高的试管中溶液先出现蓝色,说明温度高,该反应的反应速率快,反之则慢。
选修五
15.【P42科学探究】请设计实验证明溴乙烷与NaOH溶液反应后溶液中存在Br-?
答案:向一支试管中加入2mL 1mol/L 的NaOH溶液,再滴入3滴溴乙烷,振荡,充分反应后加入足量的稀硝酸酸化,加入几滴AgNO3溶液,若产生浅黄色沉淀,证明溶液中存在Br-,反之则无。
16.【P62科学探究】请设计实验,探讨乙酸乙酯在中性、酸性、碱性溶液中,以及不同温度下水解速率。
16、答案:
实验操作 | 溶液 | 现象 | 结论 |
在3支试管中各加入1mL 乙酸乙酯,再分别加入适量的稀硫酸、蒸馏水、含有酚酞的NaOH溶液,水浴加热,记录酯层消失、酯香味消失的时间 | 稀硫酸 | 酯层消失慢 | 酯在酸性条件下水解速率慢 |
蒸馏水 | 无明显现象 | 在蒸馏水中几乎不水解 | |
含有酚酞的NaOH溶液 | 酯层消失快,溶液红色变浅 | 在碱性条件下水解速率快 |
17.【P80科学探究】请设计实验,探讨果糖是否具有还原性。
答案:在试管中加入2mL 10%的NaOH溶液,滴加5%CuSO4溶液5滴,再加入2mL 10%的果糖溶液,加热,若产生砖红色沉淀,证明果糖具有还原性,反之则无。
18.【P119课后习题4】请设计高温热解聚苯乙烯泡沫塑料,回收苯乙烯的实验方案。
答案:将聚苯乙烯隔绝空气加强热,经150min热解,分馏,收集144-146°的馏分,即得到苯乙烯。
练习:
1.【2015全国卷26】设计实验证明:
①草酸的酸性比碳酸的强。
②草酸为二元酸。
答案:①向1mol/L 的NaHCO3溶液中加入1mol/L 的草酸溶液,若产生大量气泡则说明草酸的酸性比碳酸强。
②用氢氧化钠标准溶液滴定草酸溶液,消耗氢氧化钠的物质的量是草酸的两倍
2.请设计实验分离Fe(OH)3胶体中的NaCl?
答:将混合体系装入半透膜中,再将半透膜浸入蒸馏水,一段时间后,更换蒸馏水重复实验,取最后一次实验中的蒸馏水于试管中,加入几滴稀硝酸酸化的AgNO3溶液,若没有白色沉淀产生,说明胶体中的NaCl已经分离完全;反之则继续进行渗析实验至检测时无白色沉淀产生。
3.请设计实验证明淀粉分子不能透过半透膜而Cl-可以?
答:将混合体系装入半透膜中,再将半透膜浸入蒸馏水,一段时间后,取少量浸入半透膜的蒸馏水于2支试管中,向其中的一支试管中加入几滴稀硝酸酸化的AgNO3溶液,有白色沉淀产生,说明Cl—透过了半透膜;向另一支试管中加入几滴稀碘液,溶液没有变成蓝色,说明淀粉分子不能透过半透膜。
4.在溴水中加入镁粉,溴水褪色。对于褪色的原因,有两位同学进行了分析:
甲认为是溴溶于水后,溴和水发生了可逆反应:Br2+H2OHBr+HBrO。当向溴水中加入镁粉之后,则发生以下两种反应:Mg+2HBr =MgBr2+H2↑;Mg+2HBrO=Mg(BrO)2+H2↑。由于上述反应的发生,使溴水中的平衡向正反应方向移动,从而使溴水褪色。
乙认为,镁是活泼金属,在溴水中存在大量的溴,应该是溴与镁粉直接反应:Mg+Br2=MgBr2,而使溴水褪色。请设计实验方案验证。
2、答:方案一:取少量溴水于试管中,加入足量镁粉,立即观察现象,若短时间内有有大量气体产生,则甲的解释正确;若短时间内没有大量气体产生,则乙的解释正确。
方案二:取少量溴的四氯化碳溶液于试管中,加入足量镁粉,若溶液不褪色,说明镁不能直接与溴发生反应,甲的解释正确;若褪色,说明乙的解释正确。
5.将0.2mol/L 氨水逐滴加入到新制氯水中,恰好至氯水的黄绿色消失,请分析黄绿色消失的原因,并设计实验验证。
答:溶液颜色消失的原因:
一、Cl2与水反应生成2种酸,Cl2+H2OHCl+HClO,加入氨水后,中和了酸,使平衡向正反应方向移动,Cl2完全消耗,溶液的黄绿色消失;
二、Cl2有强氧化性,与氨水发生了氧化还原反应,Cl2完全消耗,溶液的黄绿色消失,
3Cl2+2NH3=N2+6HCl,3HClO+2NH3=N2+3HCl+3H2O;
取少量该新制氯水,用pH计检测该溶液的pH,再向该溶液中逐滴加入0.2mol/L 氨水至溶液的黄绿色恰好消失,再用pH计检测溶液的pH,若溶液的酸性增强,则溶液颜色消失的原因是发生了氧化还原反应;若酸性减弱,则发生了中和反应。
6.将硫酸亚铁晶体(FeSO4·7H2O)加热至高温分解,请设计一个实验来检验FeSO4的是否完全分解?
答案:将反应后的固体转移至小烧杯中,加入少量水,搅拌,过滤,取少量滤液于试管中,加入几滴K3[Fe(CN)6]溶液,若产生特征蓝色沉淀,说明FeSO4没有完全分解,反之则分解完全。
7.请设计简单实验证明:室温下HsO3-的电离平衡常数Ka与水解平衡常数Kb的相对大小?
答案:常温下,用pH试纸测定NaHSO3溶液的pH,若溶液呈酸性,则Ka>Kb;反之Ka<KB
8.已知PbCrO4和BaCrO4都是难溶于水的黄色固体,Pb(OH)2是既能溶于稀硝酸,又能溶于KOH溶液的两性氢氧化物,设计实验区别PbCrO4和BaCrO4。
答案:取少量待测物于2支试管中,分别加入过量KOH溶液,若能溶解的是PbCrO4,不能溶解的是BaCrO4。
9.某化学探究小组同学拟设计实验证明下列物质的性质,请写出设计方案的要点.
①四氯化硅常温下极易水解___________________.
②氮化硅能溶于氢氟酸不溶于硫酸________________.
答案:① 在盛水的烧杯中滴入几滴四氯化硅,观察到有白雾产生或有白色沉淀产生 .
② 在一支普通试管中加入少量Si3N4,向其中滴入硫酸,观察到固体不溶解,在另一支塑料试管中加入少量Si3N4,向其中滴入氢氟酸,观察到固体溶解 .
10.向FeCl3和KSCN的混合溶液中加入过量氯水,溶液红色褪色,某同学提出了两种假设:
①一种是过量的氯水与Fe3+结合生成了某种稳定的新物质;
②另一种则是过量的氯水将SCN-氧化了。
请你设计一个实验方案以确认哪种假设更合理?
答案:在褪色后的溶液中继续加入过量的FeCl3溶液,若溶液呈现血红色,则是过量氯水与Fe3+结合,反之,则是过量氯水将SCN-氧化。(继续加入过量KSCN溶液也可)
11.设计实验证明Ksp(AgCl)>Ksp(AgBr) (简要说明实验操作、现象和结论)
答案:向等浓度的NaCl和NaBr的混合溶液中加入少量AgNO3溶液,先产生浅黄色沉淀,证明Ksp(AgCl)>Ksp(AgBr)
12.通过以下方法配制银氨溶液
①在洁净的小试管中加入2mL 2%的AgNO3溶液,然后边振荡试管边滴加2%的稀氨水溶液,至最初产生的沉淀恰好溶解为止,制得银氨溶液。
②在制得的银氨溶液中加入无水乙醇,溶液变浑浊,过滤,用无水乙醇洗涤,得到白色固体;
③将该白色固体用适量蒸馏水溶解,得到无色溶液,用广范pH试纸检验溶液近似呈中性;向溶液中逐滴加入稀盐酸至不再产生沉淀,静置,取上层清液于另一支放有一小片铜的小试管中并微热,发现铜片的表面有气泡产生,遇到空气变成红棕色;另取少量上层清液加过量的NaOH溶液并加热,得到无色刺激性气体。由此确定通过上述方法制备的白色固体主要成分是;
⑹请根据以上探究,设计实验来制备少量纯净的[Ag(NH3)2]OH溶液:取2mL 2%的AgNO3溶液于洁净的小试管中, ,即得到[Ag(NH3)2]OH溶液。
答案:[Ag(NH3)2]nO3逐滴加入稀NaOH溶液至不再有沉淀生成(1分),过滤,用适量蒸馏水洗涤(1分),再将固体转移至小试管中,逐滴加入2%的稀氨水溶液至沉淀恰好溶解(1分)
13、在PbO2中加入H2O2,发生反应2PbO2+H2C2O4===2PbO + H2O2+2CO2↑。实验中检测到有大量O2放出,推测PbO2氧化了H2O2,通过实验证实了这一推测。实验方案是 。(已知:PbO2为棕黑色固体;PbO为橙黄色固体)
答案:取少量PbO2固体于试管中,加入足量H2O2溶液,观察到棕黑色固体转变为橙黄色固体。
14、已知草酸钙和草酸氢钙均为白色不溶物。设计一种方案确定草酸钙中是否含有碳酸钙?
答案:取一定质量的草酸钙样品于试管中,然后向试管中加入盐酸,若有气泡产生,则含碳酸钙;否则不含
15、CuCl是一种白色难溶固体,潮湿的CuCl能在空气中缓慢被氧化。请设计一个简单的实验检验CuCl中是否含有少量的CuCl2?
答案:取少量固体于试管中,加入少量除去O2的蒸馏水,并通入一定量的N2排尽试管中的空气,塞紧橡皮塞,振荡,若溶液变成蓝色,证明存在CuCl2,反之则无
16.工业上回收利用SO2的一种途径是:SO2 氨水
氨水 (NH4)2SO3
(NH4)2SO3 空气
空气 (NH4)2SO4,某同学在实验室探究步骤Ⅱ时,在一定条件下向100mL cmol·L-1的(NH4)2SO3溶液通入空气后,欲测定溶液中(NH4)2SO3的氧化率(α)。请为该同学设计实验方案(不必描述操作过程的细节,物理量的数值用字母表示):α=________×100%(用实验方案中的物理量表示)
(NH4)2SO4,某同学在实验室探究步骤Ⅱ时,在一定条件下向100mL cmol·L-1的(NH4)2SO3溶液通入空气后,欲测定溶液中(NH4)2SO3的氧化率(α)。请为该同学设计实验方案(不必描述操作过程的细节,物理量的数值用字母表示):α=________×100%(用实验方案中的物理量表示)
答案:方案一:取20.00mL 反应后的溶液于锥形瓶中,用浓度为C1mol·L-1的KMnO4溶液滴定,重复3次,平均消耗KMnO4溶液VmL。
方案二:向反应后的溶液中加入过量盐酸,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量,得到沉淀质量为m g。

- 全部评论(0)