2018年全国高考化学课标I评分细则
时间:2020-08-09 17:58 来源:未知 作者:黄利华 点击: 次 所属专题: 评分细则
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
笔者参加了 2018年湖南省高考评卷理科综合化学学 科的评卷质量检查工作。在2018年全国高考课标I理综 非选择题化学学科湖南省考生答卷中,考生的有关答题常 见错误和原因分析如下:
—、答题抽样出现的常见错误
第26题(14分)醋酸亚铬[(CH3COO)2Cr • 2H2O]为 砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧 气吸收剂。一般制备方法是先在封闭体系中利用金属锌作 还原剂,将三价铬还原为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。实验装置如图所示。回答下列问题:
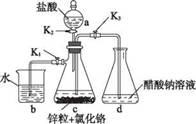
(1) 实验中所用蒸馏水均需经煮沸后迅速冷却,目的是 仪器a名称是
(2) 将过量锌粒和氯化铬固体置于c中,加入少量蒸馏 水,按图连接好装置。打开K1、K2,关闭K3。
①c中溶液由绿色逐渐变为亮蓝色,该反应的离子方程 式为
②同时c中有气体产生,该气体的作用 是______________
(3) 打开K3,关闭K1和K2。c中亮蓝色溶液流入d,其原因是_______________ ;d中析出砖红色沉淀。为使沉淀充分析出并分离,需采用的操作是____________ 、________ 、洗涤、干燥。
(4) 指出装置d可能存在的缺 点 。
(1)答案:去除水中溶解氧(2分)分液(或滴液)漏斗(2 分)



错误情况:
第一空常见的错误:除去水中的气体;防止氧气增多或 再次溶入水中;降低氧气的溶解度;防止醋酸亚铬被氧化。
第二空常见的错误:分液漏斗的“漏”写错。如将“漏” 字中的“雨”字写成了“禹”字,“漏”字的偏旁写成提手旁等。 还有部分学生写成漏斗、长颈漏斗等错误。
(2)答案:①Zn+2Cr3+==Zn2++2Cr2+(2分)

错误情况:第一种常见的错误:方程式未配平,如写成Zn +Cr3+==Zn2++Cr2+、2Zn + Cr3+==2Zn2++Cr2+、Zn+Cr3+==2Zn2++2Cr2+。
第二种常见的错误:写成了Zn+2H+ == Zn2++H2。
第三种常见的错误:将Cr的元素符号写成Co。
(2)答案:②排除c中空气(2分)

第一种常见的错误:压强增大,将液体压入d中。
第二种常见的错误:吸收氧气或作还原剂。
(3)答案:c中产生H2使压强大于大气压(2分)(冰浴)冷却(1分)过滤(1分)


第一空常见的错误:温度升高,压强增大;c中气体跑出 来,形成负压;c中形成负压,倒吸。
第二、三空常见的错误:大部分套用模版“蒸发浓缩、降温结晶、趁热过滤”。
(4)答案:敞开体系,可能使醋酸亚铬与空气接触(2分)

第一种常见的错误:没有防倒吸装置,不安全。
第二种常见的错误:没有尾气处理,会污染环境。
第三种常见的错误:醋酸钠与空气中的物质会反应变质。
第四种常见的错误:要加入一个瓶塞。
第27题(4分)焦亚硫酸钠(Na2S2O5 )在医药、橡胶、 印染、食品等方面应用广泛。回答下列问题:
(1) 生产Na2S2O5,通常是由NaHSO3过饱和溶液经结 晶脱水制得。写出该过程的化学方程式_____________ 。
(1) 利用烟道气中的SO2生产Na2S2O5的工艺为:
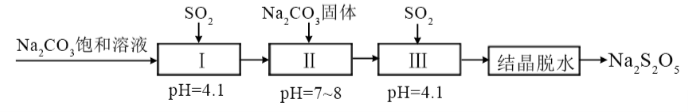
①pH = 4. 1时, I中为 溶液(写化学式)
②工艺中加入Na2CO3固体、并再次充入SO2的目的 是 。
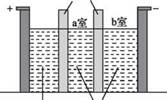
(3)制备Na2S2O5也可采用三室膜电解技术,装置如图 所示,其中SO2碱吸收液中含有NaHSO3和NaSO3。阳极的电极反应式为___________ 。电解后,__________ 室的NaHSO3浓度增加。将该室溶液进行结晶脱水,可得 到 Na2 S2 O5
(4)Na2S2O5可用作食品的抗氧化剂。在测定某葡萄 酒中Na2S2O5残留量时,取50. 00 mL 葡萄酒样品,用 0. 010 00 mol • L 1的碘标准液滴定至终点,消耗10.00 mL“滴定反应的离子方程式为___________,该样品中Na2S2O5的残留量为_______ g/ L (以SO2计)
(1)答案:2NaHSO3 == Na2S2O5 + H2O (分)

第一种常见的错误:方程式未配平"
第二种常见的错误:化学式写错了,如写成了"NaS2O5、 NS2O5、NaS2O3 ";
第三种常见的错误:写成了离子反应方程式"
(2) 答案:①NaHSO3 (分)②得到NaHSO3过饱和溶 液(分)

第一空常见的错误:大部分的考生化学式写错了 “如 写成 NaHCO3、NaHSO4、Na2S2O5。
第二空常见的错误:将“饱和”二字写成“饱合”,只写了 “饱和溶液”,未强调“过饱和”,写成了 “Na2S2O5过饱和溶液”
(3)答案:2H2O-4e-==4H++O2 (2分) a (2分)

第一空常见的错误:电极方程式没有配平,电子或水前面的系数错误;将“-e- ”写成了 “+e- ”;电极反应未用“==”连接,而用“一”连接"
第二空常见的错误:“a”的书写非常不规范,无法辨认; 写成“A”的情况普遍;写成“b”。
(4)答案:S2O52-+2I2+3H2O==2 SO42-+4I-+ 6H+; (2分) 0. 128(2 分)


第一空常见的错误:方程式完全书写错误,反应物和生 成物写成其他物质;方程式未配平;化学式、离子符号书写不规范,如将“I”写成“1”,将“S2O52- ”写成“S2O5”。
第二空常见的错误:未填或填的结果完全不对;计算正 确,但是用百分数表示,写成了“12.8%”;计算正确,但是未用标准的科学计数法表示。
第28题(5分)采用N2O5为硝化剂是一种新型的绿色硝化技术,在含能材料、医药等工业中得到广泛应用。回 答下列问题:
(1) 1840年Devil用干燥的氯气通过干燥的硝酸银,得 到N2O5。该反应的氧化产物是一种气体,其分子式为 。
(2) F. Daniels等曾利用测压法在刚性反应器中研究了 25℃时N2O5(g)分解反应:
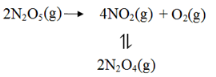
其中NO2 二聚为N2O4的反应可以迅速达到平衡。体 系的总压强p随时间t的变化如下表所示(t=∞时, N2O5(g)完全分解):

①已知:2N2O5 (g) 2N2O4 (g) + O2 (g) ΔH1 =一 4.4KJ / mol
2N2O4 (g) + O2 (g) ΔH1 =一 4.4KJ / mol
2NO2 (g)  N2O4 (g) ΔH2== 一 55. 3KJ /mol
N2O4 (g) ΔH2== 一 55. 3KJ /mol
则反应N2O5 (g)  2NO2 (g) +
2NO2 (g) +  O2 (g)的ΔH =__________ KJ /mol 。
O2 (g)的ΔH =__________ KJ /mol 。
②研究表明,N2O5 (g)分解的反应速率ν=2×10 -3 ×p(N2O5) (KPa/ min )。 t= 62 min 时,测得体系中 p(O2)= 2. 9 KPa,则此时的p(N2O5)= KPa,ν=_______________ KPa /min 。
③若提高反应温度至35°C,则N2O5(g)完全分解后体系压强p∞(35℃ )_____ 63.1 KPa(填“大于”“等于”或“小于”),原因是________ 。
④25C时N2O4(g) 2NO2(g)反应的平衡常数KP =_______________ KPa(KP为以分压表示的平衡常数,计算结果保留1位小数)。
2NO2(g)反应的平衡常数KP =_______________ KPa(KP为以分压表示的平衡常数,计算结果保留1位小数)。
()对于反应 2N2O5 (g) 4NO2 (g) + O2 (g), R. A. Ogg提出如下反应历程:
4NO2 (g) + O2 (g), R. A. Ogg提出如下反应历程:
第一步N2O5 NO2+NO3 快速平衡
NO2+NO3 快速平衡
第二步 NO2+NO3  NO+NO2+O2 慢反应
NO+NO2+O2 慢反应
第三步 NO+NO3  2NO2 快反应
2NO2 快反应
其中可近似认为第二步反应不影响第一步的平衡。下 列表述正确的是( ) (填标号)
A. ν(第一步的逆反应)>ν(第二步反应)
B. 反应的中间产物只有NO3
C.第二步中NO2与NO3的碰撞仅部分有效
D.第三步反应活化能较高
(1) 答案:O2(分)

第一种常见的错误:写成其他物质,如NO、NO2。
第二种常见的错误:O2”写得很不规范,下标“2”写得像“1”或“3”,不能准确辨认。
(2)
答案:①53. 1(1分)

常见的错误:大部分的错误是未计算正确,得到的是完全错误的计算结果。
(2)答案:② 30.0(2 分)6.0×10 2(分)

常见的错误:计算错误;书写不规范,如“3”写得像5”, “0”写得像“9”,“10 -2 ”写得像“10-3 ”等等,无法准确地 辨认。
(2)答案:③大于(分)温度提高,体积不变,总压强提高;NO2 二聚为放热反应,温度提高,平衡左移,体系物质的量增加,总压强提高(3分)

第一空常见的错误:将“大于”写成“增加”、“大”、“>”等, 个别考生填“小于”或“等于”或用其他符号表达。
第二空常见的错误:两个计分点,少答一个;答体积变 小或增大等;答正反应为吸热反应,温度升高平衡正向移 动,正向是分子数增大的方向,所以压强增大。
(2) 答案:④13. 4(2分)
第一种常见的错误:计算错误。
第二种常见的错误:未按要求保留一位小数,写成整数或有两位小数的答案。
(3) 答案:AC(2分)

常见的错误:少填、多填或错填的情况者较多。
第35题(5分)Li是最轻的固体金属,采用Li作为负 极材料的电池具有小而轻、能量密度大等优良性能,得到广 泛应用。回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低 和最高的分别为 、 (填标号)

(2)Li+与H-具有相同的电子构型,r(Li+ )小于r(H-),原因
(3) LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是___________ 、中心原子的杂化形式为 。LiAlH4中存在____________ (填标号)。
(4) L i2O是离子晶体,其晶格能可通过图(a)的 Born- Haber循环计算得到。

可知,Li原子的第一电离能为_________ kJ• mol-1,O=O键键能为______ kJ • mol-1,Li2O晶格能为____ kJ• mol -1。
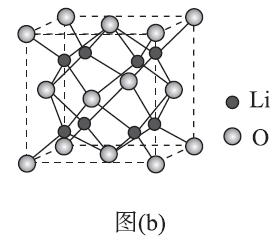
(5) Li2O具有反萤石结构,晶胞如图(b)所示。已知晶 胞参数为0.466 5 nm,阿伏加德罗常数的值为NA,则Li2O 的密度为 g/ cm3(列出计算式)。
(1) 答案:(1)D(1分)C(1分)

常见的错误:错填、少填或多填。
(2) 答案:Li+核电荷数较大(2分)

第一种常见的错误:同主族,从上到下半径减小;同一 周期,半径变小。
第二种常见的错误:Li+的原子核大,吸引能力强,半径 小;Li+的质子大。
第三种常见的错误:Li+比H-多一个电子层。
(3) 答案:正四面体(1分)sp3(1分)AB(2分)

第一空常见的错误:四面体、正四面形、三角锥。
第二空常见的错误:sp2、sp。
第三空常见的错误:少选或错选。
(4) 答案:520(2 分)498(2 分)2908(1 分)
第一空常见的错误:1040、318。
第二空常见的错误:249、703。
第三空常见的错误:2908。
(5)(答案)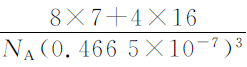 (2分)
(2分)

常见的错误:完全列式错误、nm的单位换算错误、列式运算后错误。
第36题(15分)化合物W可用作高分子膨胀剂,一种合成路线如下:
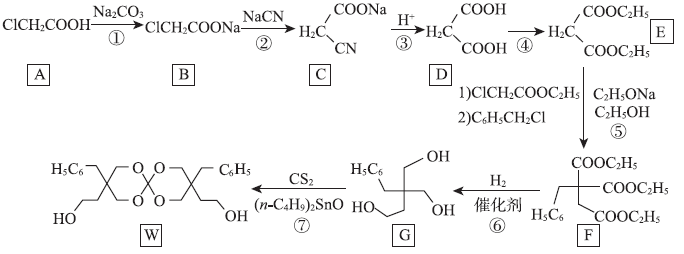
回答下列问题:
(1)A的化学名称为___________________
(2) ②的反应类型是
(3) 反应④所需试剂、条件分别为
(4) G的分子式为
(5) W中含氧官能团的名称是
(6)写出与E互为同分异构体的酯类化合物的结构简式(核磁共振氢谱为两组峰,峰面积比为1 : 1)___________
(7)苯乙酸苄酯( 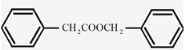 )是花香型香料,设计由苯甲醇为原料制取苯乙酸苄酯的合成路线 (无机试剂任选)
)是花香型香料,设计由苯甲醇为原料制取苯乙酸苄酯的合成路线 (无机试剂任选)
(1)答案:氯乙酸(2分)

常见的错误:错答为“2-Cl乙酸”“乙酸氯”“1-氯乙酸” “二氯乙酸”或“2-氯-乙酸”
(2)答案:取代反应(1分)

常见的错误:答为“加成反应”或“消去反应”
(3)答案:乙醇/浓硫酸、加热(2分)
第一种常见的错误:将“乙醇”写成“CH2CH3OH”。
第二种常见的错误:将“浓硫酸”写成“稀硫酸”、氢氧化钠醇溶液或酸性高锰酸钾"
第三种常见的错误:没有写加热、没有写乙醇或没写浓硫酸"
(4)答案:C12H18O3(2 分)

常见的错误:“C”、“H”、“O”的原子个数数错了。
(5)答案:羟基、醚键(分)

第一种常见的错误:关键字写错。“羟”“醚”的偏旁写错了
第二种常见的错误:错答为“酯基”“醇基”“醚”“羧基”
第三种常见的错误:多答了其他官能团。
(6)答案:
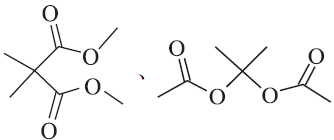

常见的错误:大部分的考生写出的结构简式不符合题目的要求,多氢少氢的现象非常多。
(7)答案:
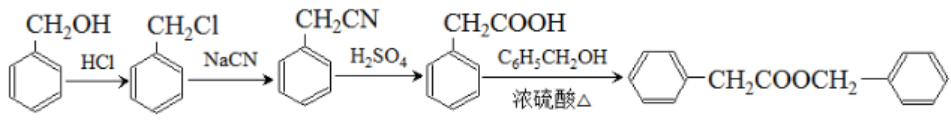

常见的错误:将 -CH2OH 写成
-CH2OH 写成  - CH3OH ;将
- CH3OH ;将  -CH2COOH 写成
-CH2COOH 写成  -CH3COOH
-CH3COOH
二、错误原因分析
(―)书写不规范
很多失分的原因是书写无法辨认而导致扣分。在中文 的书写时常出现错别字,如“饱和”写成“饱合”、“过滤”的 “滤”右边写成“虚”等。化学符号的书写时,有字母书写不 清楚,无法辨认;离子符号的上下标明显错误等。特别值得 注意的是答题的位置出现错误,无法判断是哪一空的答案 等。高考试卷的必做题有划线的格子,但是整体答题的地 方不大,要在对应的空格处准确作答。选做题没有任何划线的格子,考生可以根据自己的答题顺序写明序号作答。 不必要的失分"
(二)未按要求答题
高考试卷很多题目对答题的要求做了明确的规定,如 第28题(2)③要求填“大于”“等于”或“小于”,但是很多考生的考试习惯不好,未看到或其他原因,回答“>”、“增大”等不规范的答案。再如28题的很多计算空,后面给出了单位,考生只需要在答卷中写得数即可,但是部分考生回答时带了单位,而且单位错误了,导致扣分。28题(2)④明确要求答案“保留一位小数”,未按要求回答的考生较多。再如 36题(3)要求填写“所需试剂、条件分别为 ”,但是很多只写了“ 试剂”或“ 条件”,未得全分。 再 26 (4) 题目问“可能存在的缺点”,部分考生答成改进实验装置,且改进得不科学导致扣分。
(三)基础知识薄弱
有少数的考生基础知识薄弱而失分。如26题(1)填写 “a的名称”,部分考生答成了 “长颈漏斗”等等。再如27题(3)填电解硫酸的阳极电极反应式,28题(2)①通过盖斯定律计算反应热等等,失分的考生也较多。
(四)整合信息的能力欠缺
2018年化学《考试大纲》明确指明考查学生“接受、吸 收、整合化学信息的能力”。整套高考试卷的信息随处可见。但是根据答题的情况可以看出部分考生接受、吸收、整合化学信息的能力不足。如26题题干给出信息醋酸亚铬在“气体分析中作氧气吸收剂”,“难溶于冷水”,但是部分考生在第(3)问的分离操作中回答“蒸发浓缩”,没有根据信息准确地提取实质性内容,所以未考虑到醋酸亚铬在蒸发浓缩时会被氧气氧化等信息内涵,再如27题,题干提到“生 产Na2S2O5,通常是由NaHSO3过饱和溶液经结晶脱水制得”,部分考生错误的吸收了“结晶脱水”的信息,在(1)写出该过程的化学方程式,答出了“Na2S2O5 • xH2O”等情况。
(五)解决问题的能力不足
2018 年化学《考试大纲》明确指出 “分析和解决化学问题的能力”,指名会“分析和解决问题的过程及成果,能正确地运用化学术语及文字、图表、模型、图形等进行表达,并做出合理解释。”如28题(2)③要求解释“若提高反应温度至35°C,则N2O5(g)完全分解后体系压强”变化的原因,大部分考生不能根据题干的信息找到正确的反应方程式“2NO2 (g) N2O4(g)”来解决问题,而是依据“N2O5(g)==2NO2 (g) +
N2O4(g)”来解决问题,而是依据“N2O5(g)==2NO2 (g) +  O2 (g)”错误地解决问题;还有部分考生已考虑到压强变化的本质原因,但是不能用准确的文字表达清楚,甚至出现歧义而失分。
O2 (g)”错误地解决问题;还有部分考生已考虑到压强变化的本质原因,但是不能用准确的文字表达清楚,甚至出现歧义而失分。

- 全部评论(0)
