共价键为什么具有方向性和饱和性?
时间:2019-11-11 16:10 来源:未知 作者:化学自习室 点击: 次 所属专题: 共价键
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
共价键的形成是由于成键原子的电子云相互重叠,如果电子 云重叠愈多,构成的共价键愈牢固。因此形成共价键时,两原子在可能的范围内一定采取电子云密度最大的方向相重叠。除s电 子云是球形对称的,其他如p、d、f电子云都有一定的形状和空间伸展方向。例如p电子云是哑铃形状,在空间沿3个直角坐标 方向(x、y、z)呈轴对称。当另一个原子具有不成对的单电子与 p电子成键时,它必须沿x、y、z轴趋近,才能与p电子达到最 大程度的重叠。如H原子与C1原子结合而成HC1分子时,可能有2 种结合方式,如图所示。
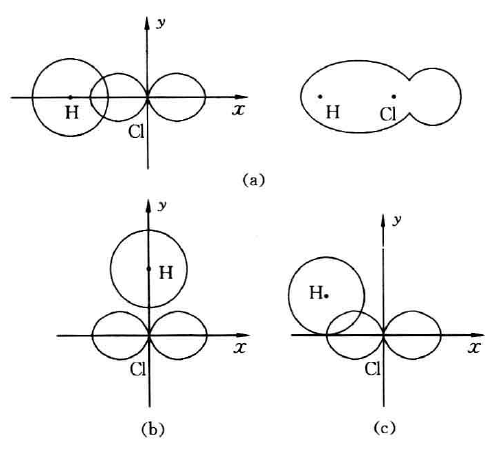
第二种情况是s电子云沿着与p 电子云垂直的方向去重叠, 结果不能成键。第三种情况是s电子云与p电子云沿着非坐标轴 任意方向去重叠,仅发生局部重叠。只有第一种情况是电子云沿 着Px电子云的对称轴方向(即电子云伸展方向)去重叠,结果是 电子云发生了最大程度的重叠,构成稳定的共价键。因此使共价键具有方向性。
在共价化合物中,一个原子的1个电子与另一个原子的1个 自旋方向相反的电子配对之后,已达稳定状态,就不能再和另一 个原子的未配对的电子再配对。例如2个H原子各拿出1个未配对电子,在它们自旋方向相反的情况下配对成H2,就不能再和第 三个H原子相结合成H3。这种特性就叫做共价键的饱和性。
(责任编辑:化学自习室)

说点什么吧
- 全部评论(0)
还没有评论,快来抢沙发吧!
