离子半径与核间距有什么关系?
时间:2023-05-18 11:23 来源:未知 作者:化学自习室 点击:次 所属专题: 半径分类
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
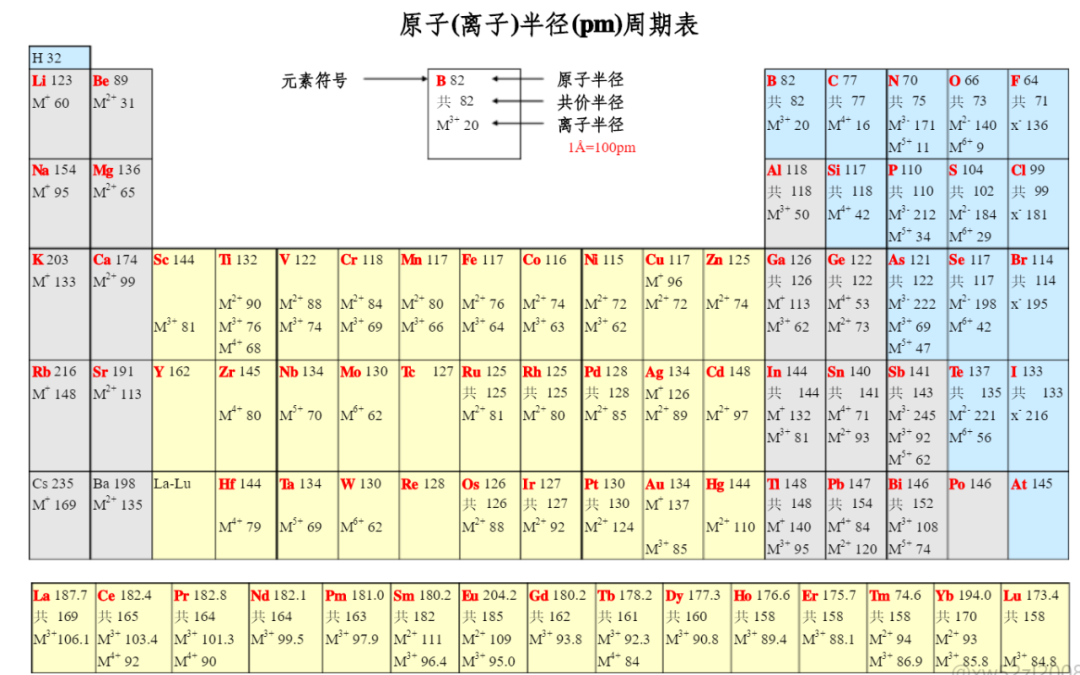
【定义】又称离子有效半径,是通过实验测定的。一般认为的离子半径是:离子晶体中相邻的两个正负离子的核间距是正负离子的半径之和。若核间距为d,则d=r++r-(r+,r-分别代表正负离子的半径)。已知一个离子的半径和核间距,就可以求出另一离子的半径。原子失去电子形成的阳离子的半径比其原子半径小,如Na原子半径为 1.537×10-10米,而Na+离子半径为0.95×10-10米。原子得到电子形成的阴离子的半径比其原子半径大,如Cl原子半径为0.99×10-10米,而Cl-离子的半径为1.81×10-10米。
【说明】
1.由于电子的波动性,离子不可能有确切的界面,所以很难确定它的真正半径。又因离子具有(或近似具有)球对称电子云,通常把阳、阴离子不等径圆球相切时的核间距作为两个离子的离子半径的和。因此,离子半径指离子在晶体中的“接触”半径。
2.离子并非钢性圆球。为了使阳、阴离子在晶体中各跟尽可能多的异号离子接触,从而使体系的能量尽可能低,阳、阴离子必须在不同晶体中采用不同的密堆积方式。同一种离子在不同晶型中表现的“接触”半径也有不同。一般所说的离子半径,是以NaCl型离子晶体为标准的数值。
3.阳离子是由原子失去电子而形成的,它的半径总比相应原子半径小(rNa+=95pm, rNa=157pm)。阴离子半径因最外层电子数增多,它比相应的原子半径大(如rCl-=181pm, rCl=99pm)。一般来说,阳离子半径较小,阴离子半径较大。
4.周期表中各元素的离子半径变化规律有:
(1)同一周期中阳离子半径随价数增加而减小,而阴离子半径随价数降低略有减小。
(2)同族元素的离子半径从上到下逐渐增大。
(3)周期表中左上方和右下方对角线上元素的相应价态离子(如Na+、Ca2+和Y3+;Ti4+、Nb5+和W6+;Li+和Mg2+等)的离子半径比较接近。
(4)同种元素阳离子的价态越高,半径越小(rFe2+=76pm,rFe3+=64pm)
(5)同价镧系元素的离子半径随原子序数的增加而减小。因此,镧系后的元素跟前一周期的同族元素(如锆和铪、铌和钽、钼和钨)离子半径大致相等。这跟规律(2)所述有所不同
离子半径是反映离子大小的一个物理量。离子可近似视为球体,离子半径的导出以正、负离子半径之和等于离子键键长这一原理为基础,从大量x射线晶体结构分析实测键长值中推引出离子半径。离子半径的大小主要取决于离子所带电荷和离子本身的电子分布,但还要受离子化合物结构型式(如配位数等)的影响,离子半径一般以配位数为6的氯化钠型晶体为基准,配位数为8时,半径值约增加3% ;配位数为4时,半径值下降约5%。负离子半径一般较大,约为1.3~2.5埃;正离子半径较小,约为0.1~1.7埃。根据正、负离子半径值可导出正、负离子的半径和及半径比,这是阐明离子化合物性能和结构型式的两项重要因素。
例如:Na+在配位数为4、6、8、9、12时,离子半径分别是99、102、118、124、139 pm;O2-离子的半径在配位数为2、6、8时,离子半径分别为121、140、142 pm等。

- 全部评论(0)
