缓冲溶液解读
时间:2019-11-15 10:58 来源:未知 作者:化学自习室 点击: 次 所属专题: 缓冲溶液
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
例 :取纯水、KCl溶液、HAc与NaAc的混合液各 90 mL 进行实验,实验做法和结果见下表。
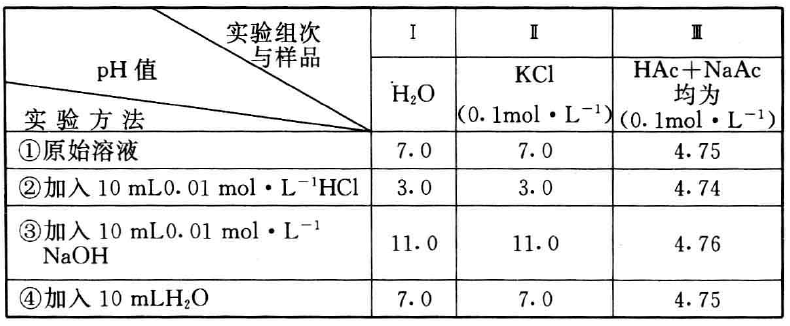
问:(1)从实验结果可得出什么结论?
(2) 试解释第I组实验的实验结果?
(3) 试推测哪类溶液可具有第I组溶液的性质?
[解析](1)实验结果表明,加入少量酸或碱后,纯水和KCl 溶液的pH值发生了较大的变化,而HAc-NaAc混合溶液pH值变化很小,同时少量稀释pH值也不变,说明它具有抗御少量酸、 碱和稀释的能力。
(2) 在 HAc-NaAc 混合溶液中有:NaAc = Na++ Ac-, HAc H++Ac-。
H++Ac-。
其中[HAc]和[Ac-]是较大的,当加入少量强酸后Ac-会 与其结合成HAc,使平衡向左移动,因此基本保持原来[H+]。当 加入少量强碱时,溶液中的H+与OH-结合成水,使HAc进一步 电离补偿所消耗的H+,从而使溶液中[H+]基本不变,因此该体系可抵御外来少量酸碱的影响。当适当稀释时,虽降低了溶液 的[H+],但由于HAc电离度增大和同离子效应的减弱又使 [H+]有所提高,更重要的是[HAc]和[Ac-]等比例减少,比值不变,所以溶液的pH值基本不变。
(3) 由上述分析可知,较高浓度的共扼酸碱对混合液,即弱 酸(弱喊)及其盐的混合液在一定范围内具有抵御少量酸碱和稀释 的作用,这种作用叫缓冲作用,具有缓冲作用的混合液叫缓冲溶液。
中学化学中最典型的弱酸型和弱碱型缓冲溶液分别为HAc- NaAc混合液和NH3 • H2O-NH4Cl混合液。
(责任编辑:化学自习室)

说点什么吧
- 全部评论(0)
还没有评论,快来抢沙发吧!
