酸碱滴定法知识详细
时间:2016-02-02 22:03 来源: 作者:赵亭 点击:次 所属专题: 中和滴定
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
[引言]:以酸碱中和反应为基础的滴定分析方法叫酸碱滴定法又叫中和法。一般的酸碱以及能与酸碱直接或间接发生中和反应的物质几乎都可以用酸碱滴定法测定。
第一节 酸碱指示剂
[引出] 什么是终点? (指示剂变色点)
什么样的物质可以作指示剂?不同指示剂变色点为什么不同?(如酚酞:无色(酸性溶液中)→ 红色(碱性溶液中);甲基橙:红色 → 橙 → 黄
一、酸碱指示剂的变色原理
1.酸碱指示剂 :通过颜色变化来指示溶液酸碱度的一类试剂叫酸碱指示剂。如酚酞;、甲基橙。
用途:①指示酸碱滴定的终点。
②测定溶液的PH值。
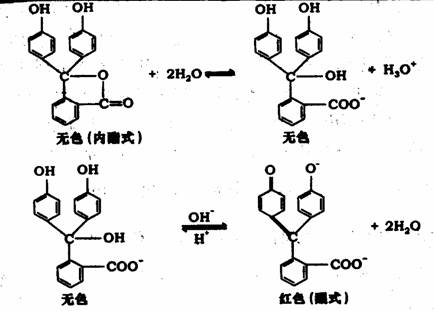 |
2.变色原理:酸碱指示剂一般是弱的有机酸或有机碱,其共轭酸碱对具有不同的结构,因而呈现不同的颜色。例如:酚酞HIn![]() H++In-
H++In-
当溶液pH值改变时,酸式结构与碱式结构相互转化,而酸式、碱式对应不同的颜色,故指示剂自身颜色的变化同时改变了滴定溶液的颜色。
[引出] 上述两种指示剂变色时溶液的pH值有无不同?能否计算指示剂变色时溶液的pH值?
3.酸碱指示剂的变色点变色范围:以有机弱酸为例。
根据电离平衡方程式可得:KHIn == ![]()
![]() [H+] == KHIn·
[H+] == KHIn·![]() ,pH == P KHIn — lg
,pH == P KHIn — lg![]()
(1)理论变色点
当[HIn] == [In-]时,pH == p KHIn为指示剂的理论变色点。
酸性溶液中,以HIn色为主;当In-的量增多至与HIn的量相等时,显示酸式、碱式的混合色;[In-]大于[HIn]时,显示碱式色。
故[HIn] == [In-]是颜色刚好开始变化的位置,称为变色点。
(2)指示剂的变色范围:由于人眼辨色能力的原因,定量来讲,
![]() > 10,呈酸色 ,pH≤PKHIn-1
> 10,呈酸色 ,pH≤PKHIn-1
![]() <
< ![]() ,呈碱色, pH≥PKHIn+1
,呈碱色, pH≥PKHIn+1
![]() <
< ![]() < 10,混合色。pKHIn-1≤pH≤pKHIn+1
< 10,混合色。pKHIn-1≤pH≤pKHIn+1
即由酸色变为碱色时,溶液pH值从p KHin —1变为 p KHIn + 1才能观察到颜色的变化。
pH == pKHin ± 1 就是指示剂的理论变色范围。.不同指示剂的变色范围、理论变色点不同;
[说明]a:由于人眼对颜色的敏感程度不同,加上指示剂的两种颜色相互掩盖实际变色范围与理论变色范围有差别;(如甲基橙, p KHIn ==3.4,理论变色范围是2.4~4.4,实际变色范围是3.1~4.4
如:甲基橙KHIn=4×10-4 pKHIn=3.4(理论变色点)
理论变色范围2.4~4.4,实际变色范围3.1~4.4
当pH=3.1时 [H+]=8×10-4mol·L-1
![]()
![]() 酸色(红色)
酸色(红色)
当pH=4.4时 [H+]=4×10-5mol·L-1
![]()
![]() 碱色(黄色
碱色(黄色
b.根据溶液的实际情况选择合适的指示剂。
[引出] 指示剂变色范围的宽窄对地丁的准确度有无影响?
二、混合指示剂
一般单一指示剂的变色范围较宽,变色不敏锐,且变色过程有过度色,不易于辨别颜色的变化。而混合指示剂具有变色范围窄、变色明显的特点。
1.使指示剂的变色范围变窄;
2.使颜色变化更容易辨别;
(1)混合指示剂的配制有两种方法。
指示剂 + 染料(不随PH变色)如:甲基橙+靛蓝
指示剂1+指示剂2 如:甲基红+百里酚蓝
常见的混合指示剂列于8—2
把甲基红、酚酞、百里酚蓝、溴百里酚蓝按一定比例混合溶于乙醇配成的混合指示剂随PH值而逐渐变色,也可制成PH试纸。用来测定pH值。
pH ≤ 4 5 6 7 8 9 10 (≥10)
第二节 酸碱滴定曲线和指示剂的选择
 |
(本节的重点,滴定曲线的绘制过程及意义均应详细讲解)
[引出] 如何正确选择指示剂以提高滴定的准确度? (由滴定曲线来确定)
酸碱滴定曲线:在酸碱滴定过程中,溶液PH值随滴定剂的加入而变化,以滴定剂的加入量或中和百分数为横坐标,溶液pH值为纵坐标作图所得曲线称为酸碱滴定曲线。
酸碱滴定曲线的用途
1.由曲线可观察滴定过程中溶液pH值的变化情况,由此判断被物质能否被准确滴定。
2.选择合适的指示剂。
一、强酸强碱的滴定
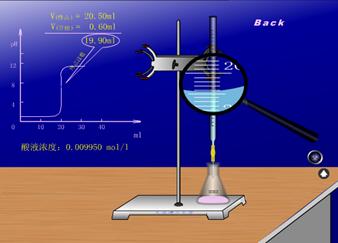
以0.1000mol·L-1NaOH标准溶液滴定20.00mL 0.1000 mol·L-1HCl溶液为例讨论强酸强碱相互滴定时的滴定曲线和指示剂的选择。以0.1000mol·L-1NaOH溶液滴定20.00mL,0.1000mol·L-1HCl为例。
1.滴定曲线的绘制
(1)滴定前 pH==1.00
(2)等量点前 溶液的pH值取决于溶液中未被滴定的剩余酸的量:
[H+]==![]()
VNaOH | 18.00 | 19.80 | 19.98 |
中和百分数 | 90 | 98 | 99.9 |
pH值 | 2.28 | 3.30 | 4.30 |
(3)量点时 pH==7.00
(4)等量点后 溶液的pH值取决于过量的NaOH的浓度。若加入20.02mL(100.1%)
[![]() ==
==![]()
=5.00×10-5mol·L-1
pH==9.70
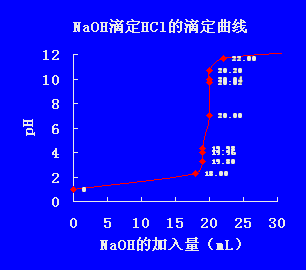 |
可见,等量点前后0.1%,溶液的pH值由4.30 → 7.00 → 9.70,数值发生突然的变化,称为“突变”。
2.滴定突跃:在滴定过程中,在等量点前后±0.1%相对误差范围内pH值发生了很大变化(突变)称为滴定突跃。
3.突跃范围:该指示剂的滴定突跃所在的pH值范围称为PH突跃范围
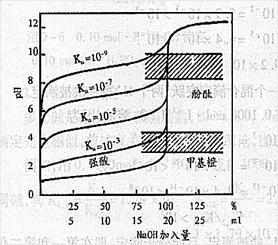
4.选择指示剂的原则:指示剂的变色范围全部或部分落在滴定的突跃范围内。。所以以上的滴定突跃pH=4.30~9.70 凡是变色范围部分或全部在4.30~9.70范围内的指示剂都可使用。
如:酚酞8.0~10.0
甲基红4.4~6.2
甲基橙3.1~4.4
[指出]
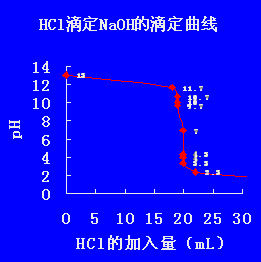 |
1.若用HCl滴定NaOH (条件同前,滴定曲线的形状相同、方向相反,突跃范围pH=9.70~4.30 同样可选酚酞、甲基红、甲基橙作指示剂。
2.突跃范围的大小与酸、碱浓度有关
突跃范围的大小与强酸强碱溶液的浓度有关。
二、一元弱酸弱碱的滴定
(一)强碱滴定一元弱酸
以0.1000 mol·L-1NaOH滴定20.00mL 0.1000 mol·L-1HAc为例,讨论强碱滴定一元弱酸的滴定曲线和指示剂的选择。
![]() NaOH+HAc NaAc+H2O
NaOH+HAc NaAc+H2O
(1)滴定前,溶液中的H+来自HAc的电离。依照弱酸的电离计算:
[H+]==![]() ==1.33×10-3(mol·L-1) pH==2.88
==1.33×10-3(mol·L-1) pH==2.88
(2)等量点前,HAc与滴定反应的产物NaAc形成缓冲溶液:
pH==pKa — lg![]() ,当加入19.98mLNaOH时,剩余0.02mLHAc
,当加入19.98mLNaOH时,剩余0.02mLHAc
[HAc]==![]() ==5.00×10-5
==5.00×10-5
[Ac-]==![]() ==5.00×10-2
==5.00×10-2
pH=pka-lg10-3=7.75
(3)等量点时,溶液的pH值由产物NaAc的水解决定:
[OH-]==![]() ==
== ==
==![]() ==5.30×10-10,pH==8.72
==5.30×10-10,pH==8.72
(4)等量点后,溶液的pH值由过量的NaOH决定。加入20.02mLNaOH时:
[OH-]==![]() ×0.1000==5.00×10-5mol·L-1,pH==9.70
×0.1000==5.00×10-5mol·L-1,pH==9.70
计算结果列于表8-4以NaOH加入量为横坐标,以pH为纵坐标画出滴定曲线。
1.滴定曲线特点
(1)起点高,因HAc较HCl酸性弱;
(2)开始至20%HAc被滴定时,斜率较大。因Ac-的生成减小了HAc的电离;
(3)随NaOH加入CNaOH↑,CHAc↓缓冲能力增强,所以PH增加较慢;
(4)接近等量点时,缓冲能力减弱,Ac-水解增加,PH增加较快;
(5)等量点时,HAc浓度急剧减小, pH发生突变7.75~9.70;
(6)由于NaAc的水解,接近等量点时,溶液PH值已经在碱性范围内,所以NaOH—HAc滴定曲线的突跃范围(7.75~9.70)比NaOH—HCl(4.30~9.70)小得多,而且在碱性范围内。
所以,在酸性范围内变色的指示剂(如甲基橙、甲基红)不能用于该滴定。只有酚酞可用于指示NaOH滴定HCl的终点到达。
2.影响突跃范围的因素
(1)浓度一定时,Ka越大,突跃越大;
(2)Ka一定时,浓度越大,突跃越大;
(3)两者同时变化时,其乘积越大,突跃越大浓度有关。只有cKa≥10-8时,滴定才有明显的pH突跃,才能借助指示剂判断终点。
所以,cKa≥10-8是判断弱酸能否被准确滴定的依据。
(二)强酸滴定一元弱碱
以0.1000 mol·L-1HCl滴定20.00mL 0.1000 mol·L-1NH3·H2O为例
1.滴定曲线与NaOH滴定HAc相似,但pH变化方向相反;
2.由于反应产物是NH4Cl,等量点时,溶液呈酸性,突跃范围PH=6.30~4.30;
3.可用甲基橙、甲基红指示终点,不能用酚酞;
4.碱性太弱或浓度太低都不能借助指示剂判断滴定终点。只有CKa≥10-8时,才能被强酸准确滴定。
三、多元酸碱的滴定(简介)
(一)多元酸的滴定
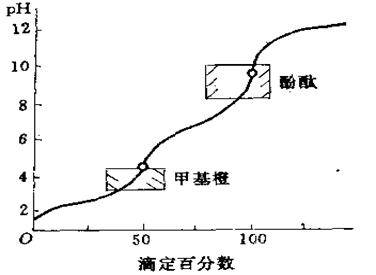 |
如二元酸H
1.CKa1≥10-8,CKa2≥10-8 时,两个H+均可被准确滴定。
2.![]() 时,会形成两个明显突跃,可分步滴定。
时,会形成两个明显突跃,可分步滴定。
同时符合CKa1≥10-8,CKa2≥10-8

CKa1≥10-8 、CKa2<10-8 而且 Ka1/Ka2>10-5 只有第一级电离的H+被滴定。
(二)多元碱的滴定
多元碱是指多元弱酸与强碱作用生成的盐,如:Na2CO3 Na2B4O7·H2O 等
强酸滴定多元碱的情况与强碱滴定多元酸类似。例如:
0.1000mol·L-1HCl滴定0.1000 mol·L-1Na2CO3
CO32-+H2O=HCO3-+
HCO3-+H2O=H2CO3+
第一等量点:POH=(PKb1+PKb2)÷2=5.68 PH=8.32 酚酞
第二等量点:突跃不明显,产物H2CO3 CH2CO3=0.04 mol·L-1
[H+]=![]() =1.3×10-4 PH=3.89 甲基橙
=1.3×10-4 PH=3.89 甲基橙
第三节 酸碱标准溶液的配制和标定
(复习标准溶液配制方法、基准物质等概念)
[引出]
1.标准溶液的配制有几种方法?(标定法)
2.基准物质有什么要求?
一、酸标准溶液的配制和标定
1.配制步骤
2.基准物质
(1)无水碳酸钠
a 干燥后,冷却备用;
b 突跃范围:3.5~5.0
c 指示剂:甲基橙或甲基红
d 操作要点:近终点时摇瓶或煮沸;
e c(HCl)==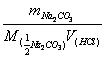
(2)硼砂(Na2B4O7·10H2O)
a.保存于60%的恒湿器中(易风化失水)
b.等量点:pH == 5.1
c.指示剂:甲基红
d.c(HCl)==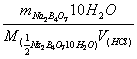
e.实验中,称取Na2B4O7·10H2O0.4~
二、碱标准溶液的配制和标定
1.邻苯二甲酸氢钾(KHC8H4O4)
(1)100~125℃烘干;
(2)pH==9.05
(3)指示剂:酚酞(4)c(NaOH)==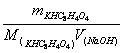
2.草酸;(H
(1)密闭容器中备用;
(2)突跃范围:7.7~10.0,等量点:8.4
(3)指示剂:酚酞
(4)c(NaOH)==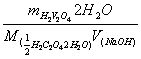
基准物质:邻苯二甲酸氢钾KHC8H4O4和草酸H
第四节 酸碱滴定法应用实例
(学生自学为主,根据反应过程选择合适的公式进行计算。重点掌握混合碱的测定)
一、碱中NaOH和Na2CO3的测定(HCl为标准溶液)
1.双指示剂法
酚酞变色时,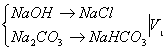
甲基橙变色;NaHCO3→NaCl ![]()
NaOH消耗HCl的体积:V1—V2,Na2CO3消耗HCl的体积:2V2
根据公式计算
2.BaCl2法
(BaCl2将Na2CO3沉淀,只剩NaOH)
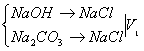 ,甲基橙变色
,甲基橙变色
加入BaCl2将Na2CO3沉淀后,NaOH → HCl ![]() ,酚酞变色
,酚酞变色
Na2CO3消耗HCl的体积:V1—V2
根据公式进行计算
二、纯碱中Na2CO3和NaHCO3含量的测定于上述方法相似(略)
本章小结
1.酸碱滴定法是滴定分析法中最基础的方法。在酸碱滴定过程中溶液的pH发生改变,随着滴定剂的不断加入而引起溶液pH改变的曲线。在整个滴定曲线。在整个滴定过程中,化学计量点前后±0.1%相对误差范围内溶液的pH突变为酸碱滴定突跃。
2.酸碱指示剂一般是指有机弱酸或有机弱碱,当溶液的pH发生改变时,其顏色发生改变,从而指示滴定终点。指示剂的变色范围pH=pKHln±1。指示剂的变色范围部分或全部落在滴定突跃内的均可用以指示滴定终点。
一元弱酸滴定的条件是cKa≥10-8。
3.多元酸滴定条件是cKa,i≥10-8,各级电离的H+方可滴定;Ka,i/Ka,i+1>105可分步滴定。弱碱情况相同。

- 全部评论(0)
