中学化学疑难问题解析(20例)
时间:2021-01-18 17:38 来源:未知 作者:化学自习室 点击: 次 所属专题: 疑难问题集
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1.实验室怎样制取二氧化硫?工业上又是怎样制取?
【答】在中是用亚硫酸钠固体与浓硫酸制取二化硫,化学方程式:Na2SO3(固)+H2SO4(浓)=Na2SO4+H2O+SO2↑
注意:不能用HNO3代替H2SO4,因为HNO3会把SO2氧化;也不能用稀H2SO4代替浓H2SO4,因为它们含水量太高,不利于SO2的逸出,—般选用较浓硫酸或稍加热,有利于SO2的逸出。
2.为什么加水稀释时弱电解质的电离平衡向正反应方向移动?
【答】这是因为往弱电解质稀溶液中加水时,反应物和生成物(阴、阳离子)都被冲稀了,但此电离平衡 的正反应是弱电解质在水分子的作用下电离的过程,逆反应是阴阳离子相互“碰撞”而结合成分子的过程, 溶液越稀,离子间的相互“碰撞”的机会越少,因此加水对逆反应的速率的降低的影响是主要的,由于V(正)> V(逆),所以电离平衡向正反应方向移动。
3.实验室里制得的乙炔为什么具有难闻的气味?如何除去?
【答】这是因为制乙快的电石中含有少量的硫化钙、砷化钙、磷化钙等杂质,这些杂质与水作用会生成 H2S、AsH3、PH3等有特殊气味的气体,因而使制得的乙快气体具有恶臭的气味。
除去的方法是将翻杂质的乙快气体通过装有CuSO4溶液或Pb(NO3)2溶液或NaOH溶液的洗气瓶,即可除去有恶臭气味的杂质气体。
4.在氢氧化亚铁被氧化的过程中出现的灰绿色物质是什么?
【答】灰绿色的物后是氢氧化亚铁氧化过程中的中间产物,其化学式为Fe3(OH)8,组成中有2/3的铁显 +3价,1/3的铁显+2价。
5.浓HNO3为什么呈黄色?工业盐酸为什么显黄色?
【答】久置的浓HNO3呈黄色,这是因为光或受热易分解,而且,浓度越大,温度越高(或光照越强),硝酸的分解越快,由于分解出的NO2又全部溶解于浓HNO3,致使HNO3显黄色。这与工业浓盐酸显黄色是燃不同的。工业盐酸的制取是将H2和Cl2化合成HCl气体,在溶于水即可。Cl2与Fe (钢管)反应生成少量FeCl3,溶于水,水合离子部分水解后呈黄色。
6.为什么铜与浓硫酸在加热条件下反应常产生黒色沉淀?
【答】铜跟浓热条件下发生反应时,常产生黑色沉淀,有时会影响蓝色溶液的现察,这往往是由于铜过量或浓硫酸的浓度不够造成的。除了教材中介绍的反应外,加热过程中还往往发生下列反应:
5Cu+4H2SO4 (浓)=3CuSO4+Cu2S↓ +4H2O
Cu2S + 2H2SO4(浓)=CuSO4+CuS↓ +2H2O + SO2 ↑
CuS + 2H2SO4(浓)=CuSO4+S ↓+SO2 ↑+2H2O
由于Cu2S、CuS都是黑色,因而使液体呈黑色。
7.如何理解浓硫酸的吸水性?
【答】(1)浓较酸的吸水作用指的是浓较酸分子跟水分子强烈结合,生成一系列的水合物 H2SO4·H2O(SO3·2H2O)、H2SO4·2H2O(SO3·3H2O}和H2SO4· 4H2O(SO3·5H2O)。 这些水合物很稳定,所以 浓硫酸的吸水性很强。
应注意的几个问题:
①就浓硫酸而言,吸水性是浓硫酸的性质,而不是稀硫酸的性质。
②浓硫酸在发挥吸水性作用的过程中,吸收水分子,水分子又和H2SO4分子化合成了稳定的水合物,并放出大量的热,故浓硫酸吸水的过程是化学变化的过程,吸水性是浓硫酸的化学性质。
③浓硫酸不仅吸收一般游离水(如空气中的水),而且还能吸收某些结晶水合物(如:CuSO4·5H2O、 Na2CO3• 10H2O)中的水。
④浓硫酸的吸水性决定了浓硫酸的另一个重要的用途,作吸水剂或干燥剂,浓硫酸是效率高的,常用的干燥剂。通常可用浓硫酸干燥的气体有 H2、CO、CO2、SO2、CH4、N2、Cl2、HCl等。常见不能用浓硫酸进行干燥的物质是那些具有还原性及碱性气体(因为浓硫酸具有强氧化性和酸性) HBr、HI、H2S、NH3、NO2。用浓硫酸作干燥剂对气体进行干燥,所用装置为洗气瓶装置。
8.如何理解浓H2SO4的脱水性?
【答】浓硫酸可将许多有机化合物(尤其是糖类如纤维素、蔗糖等)脱水。反应时,按水分子中氢、氧原 子的个数比(2: 1)夺取这些有机物分子里的氧原子和氧原子,然后结合成水分子。例如浓硫酸和蔗糖混合时,主要起脱水作用,同时浓硫酸使游离出来的碳氧化而生成二氧化碳,它自身还原而生成二氧化硫,反应放出的热使水蒸发,这些作用使有机物脱水后生成的碳体积膨胀,并呈疏松孔状。但是浓硫酸使有机物脱水时,并不一定都使碳游离出来。例如:用甲酸制取一氧化碳或用酒精泡取乙烯时,虽然浓硫酸作脱水剂,但没有碳游离出来。
C12H22O11  12C + 11H2O
12C + 11H2O
HCOOH CO↑+H2O
CO↑+H2O
C2H5OH  C2H4↑+H2O
C2H4↑+H2O
9.铜在金属活动顺序表中排在氢的后面,Cu2+的氧化性强于H+,当二者在水溶液中与Na接触 时,理应是Cu2+与Na发生罝换反应,但为什么却是H2O与Na发生反应而析出H2呢?
【答】产生这现象的原因主要有两方面:一是钠是非常活泼的金属,研究表明钠在任何水中均能易于水反应而置换出氢;另一原因,在水中Cu2+是以水合离子[Cu(H2O)4]2+形式存在,四个水分子分布Cu2+的四周, 从而阻断钠与Cu2+接触,使钠与Cu2+的反应不能进行。
10.过氧化钠与水的反应,从放出的气体使带火星的木条复燃,可知发出的是氧气,向试管滴加酚酞,溶液变红又褪色,为什么?
【答】因为Na2O2与水反应生成NaOH溶浼使无色酚酞变为红色。红色褪去的原因又多种说法,总的来说可归纳为两方面共同作用结果,一是的NaOH浓度较高;二是从反应的机理看,即Na2O2与H2O反应先生成H2O2,H2O2有分解为H2O和O2,在两个氧原子结合生成O2,我们称其为初生态氧(或原子氧〉,初生态氧有极强氧化性,能使变红的酚酞褪为无色。
11.Na2O2和H2O的反应实质是什么?
【答】很多人认为,由于:
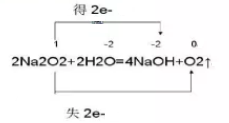
所以Na2O2的还原产物是NaOH。其实不然,Na2O2与H2O反应的机理实际上是分两部分进行的,即 Na2O2+2H2O=2NaOH+H2O2这一部分是非氧化还原反应。H2O2在碱性溶液中极不稳定,会立即分解:
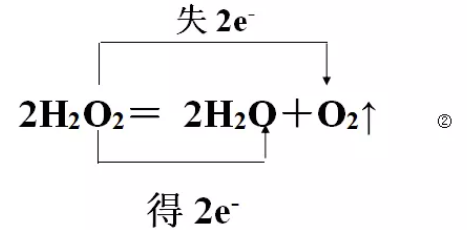
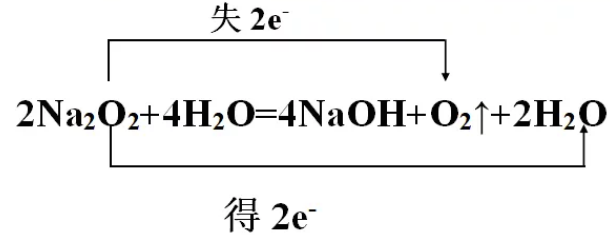
将①、②合并:①× 2+②即得总反应式:2Na2O2+2H2O=4NaOH+O2 ↑③
假如要分析电子转移情况,反应③中的两边应加上合并时被约去的两个分子的H2O,然后再进行分析,即:
12.原子的最外层电子数为什么不超过8个?
【答】由于能级的原因,End>E(n+1)S。当ns和np充满时(共4个轨道,最多容纳8个电子),多余电子不是填入nd,而是首先形成新电子层,填入(n+1)s轨道中,因此,最外层电子数不可能超过8个。
13.为什么盛放强碱的溶液可以是玻璃瓶,但瓶口不能用玻璃塞?
【答】玻璃的主要成分之一是二氧化硅,二氧化硅能与强碱生成具有粘连性,可作粘合剂的硅酸盐,例如:SiO2+2NaOH=Na2SiO3+H2O,通常玻璃制品(如玻璃瓶)表面光滑致密,在常温下不与强碱反应,玻璃瓶口用玻璃塞时,为了吻合严密、密封性好,对瓶口的内壁和瓶口塞的外壁都要做磨砂处理,磨砂后表面不在光滑致密,能与强碱缓缓发生反应。反应不仅使玻璃被腐蚀,而且生成的硅酸盐将瓶口和瓶塞粘结在很难打幵。实验室中盛放强碱,硅酸钠的容器,如用玻璃瓶,不能配置玻璃塞,而要配置橡胶塞或塑料塞。
14.稀释浓硫酸时为什么会放出大量热?
【答】当浓硫酸溶解于水时,包括两个过程,浓硫酸向水中扩散是物理过程,这个过程要吸收一定的热量,另一过程是化学过程,即硫酸分子跟水分子化合,生成水合氢离子,这个过程放出一定的热量,整个过程表示如下:
H2SO4+2H2O= 2H3O++ SO42-
硫酸与水能生成相当稳定的水合物,如H2SO4• H2O, H2SO4 •2H2O, H2SO4• 4H2O等(在低温时,这些水合物可以从溶液以晶体形式析出)。由于形成水合氢离子和各种水合物时放出大量的热(1molH2SO4在20℃与过量的水渴合,溶解热为85.5kJ/mol),放出的热量多于吸收的热量,因此,吸收H2SO4时会放出的大量的热。
15.为什么晶体硅能导电,是半导体材料?
【答】这是因为晶体娃中的Si-Si键的键能相对不大(177kJ/mol) 。 Si-Si键的两个硅原子核对共用电子对吸引力较小。在通电时,晶体硅中的共用电子对有可能摆脱两核吸引而成为自由电子,故能导电。共用电子对离开共价键结构,留下的空位成为带正电荷的空穴,自由电子和空穴的出现总是成对的,称为电子-空穴对。由于自由电子的运动,使电子-空穴对不断更换,使晶体硅导电具有一定的方向性,因此晶体硅为半导体材料。
16.为什么用分馏法得不到无水乙醇?怎样制备无水乙醇?
【答】乙醇与水组成的溶液,当浓度为95.57%时,在1.01×105Pa下,78.13℃沸腾,沸点是恒定的。对 这样的溶液进行蒸馏,无论怎样蒸馏,得到蒸气中乙醇的含量与溶液中完全一致,这样的溶液称为恒沸溶液。因此用用分馏法只能将乙醇浓度提高到95.57%,得不到无水乙醇。
要制得无水乙醇(浓度在99%以上),通常用跟新制的生石灰混合,使水与氧化钙反应生成氢氧化钙,然后蒸馏制得。
17.氯、溴、碘的正价为什么都是奇数价?
【答】卤素原子只有一成对电子,当其与电负性更强的原子结合时,失去一个未成对的电子而呈+1 价。当p轨道上的1对成对电子激发到空的d轨道后即进行sp3d杂化,这样就有三个未成对电子,成键时显+3价,以此类推,分别进行sp3d2和sp3d3杂化,成激楠素的化合价为+5、+7,所以,卤素的正价为奇数,非偶数价。
18.水溶液中为什么不可能存在O2-离子?
【答】O2-离子只存在于离子晶体中,它在水溶液中要与H2O反应,生成OH-
这是因为,首先O原子的第一电离能为正值,也就是说O (g)原子结合一个电子变成O- (g)离子是放出能量的。
![]() ΔrHm = -142 kJ/mol
ΔrHm = -142 kJ/mol
但O- (g)离子结合一个电子生成O2-离子则是吸热的。
![]() ΔrHm=844kJ/mol
ΔrHm=844kJ/mol
且I2的绝对值远大于I1,这就是说O2-的能量远比O-和O要高,O2-从能量观点来看,远不如O稳定。
当O2-离子进入水溶液时,O2-就有自发地从H2O夺取H+而变为OH-的强烈候向。只有在离子晶体中,巨大 的晶格能才能满足形成O2-离子时能量的需要,这就是O2-离子只存在于晶体中的原因。
其次,从水的电离来说,H2O H++OH-
H++OH-
常温时水的离子积为1.0×10-14,水的电离常数K1=1.8×10-16,这是一个很小数值,说明水的第一级电离是很微弱的。据计算,H2O的第二级电离:OH- H++ O2-的电离平衡常数为10-40 ,这说明OH-电离产生O2-的可能性几乎等于零。如果水溶液中存在O2-,它也要和H+反应生成OH-,即电离平衡强烈地 趋向于向左移动。从酸碱质子理论来说,O2-是很强的碱,它很容易吸收一个H+而生成OH-。这些都能说明在水溶液中是不存在O2-离子的。
H++ O2-的电离平衡常数为10-40 ,这说明OH-电离产生O2-的可能性几乎等于零。如果水溶液中存在O2-,它也要和H+反应生成OH-,即电离平衡强烈地 趋向于向左移动。从酸碱质子理论来说,O2-是很强的碱,它很容易吸收一个H+而生成OH-。这些都能说明在水溶液中是不存在O2-离子的。
19.实验室制取乙炔为什么不能使用启普发生器?
【答】①反应强烈,难以控制;②生成物Ca(OH)2微溶于水,易形成糊状泡沫堵塞导气管和球形漏斗的下口; ③反应放出大量的热,启普发生器是厚器,容易因胀结不均而破裂;④关闭导气管后,水蒸气仍与电石作用,不能达到 “关之即停”的目的。
20.实验室制备乙炔,电石与水反应很剧烈,为了得到平稳的乙炔气流,为什么常用饱和食盐 水,而不用纯水?
【答】用饱和食盐水可以降低了水的浓度;由于反应消耗了水,饱和食盐水溶液有晶体祈出,覆盖电石的表面,减缓反应的发生。

- 全部评论(0)
