把握六个关键,突破有机物制备实验
时间:2024-04-23 16:20 来源:未知 作者:化学自习室 点击: 次 所属专题: 有机物制备
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
“有机实验”在高考中频频出现,主要涉及有机物的制备、有机物官能团性质的实验探究等。常常考查蒸馏和分液操作、反应条件的控制、产率的计算等问题有机。这需要同学们掌握课本上有机制备试验以及前面复习过的蒸馏、分液等有机物常用的分离提纯方法
一、把握制备过程
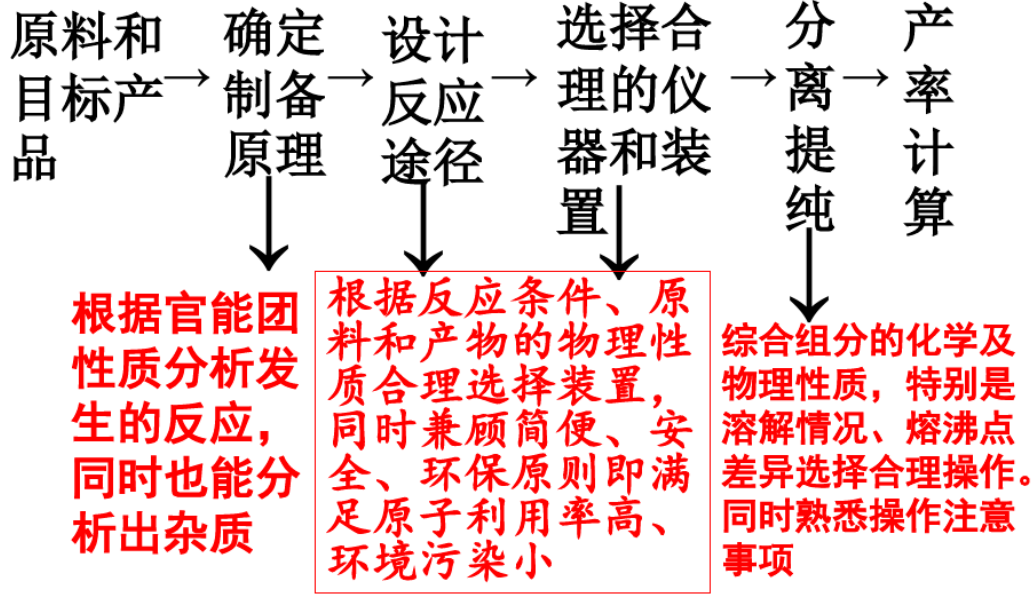
二、值得关注的物理性质规律
1、一般而言,组成和结构相似的分子晶体,熔沸点随相对分子质量增大而升高。
2、一般而言,离子晶体熔沸点大于分子晶体熔沸点。
3、一般而言,有机物容易溶解在有机溶剂中。但含有—OH、-CHO、-COOH等基团的小分子有机物易溶于水,其中乙醇极易溶于水。
4、一般而言,离子化合物更容易溶解在水中。
三、熟悉常考的问题
1、有机物易挥发,因此在反应中通常要采用冷凝回流装置,以减少有机物的挥发,提高原料的利用率和产物的产率。
2、有机反应通常都是可逆反应,且易发生副反应,因此常使某种价格较低的反应物过量,以提高另一反应物的转化率和产物的产率,同时在实验中需要控制反应条件,以减少副反应的发生。
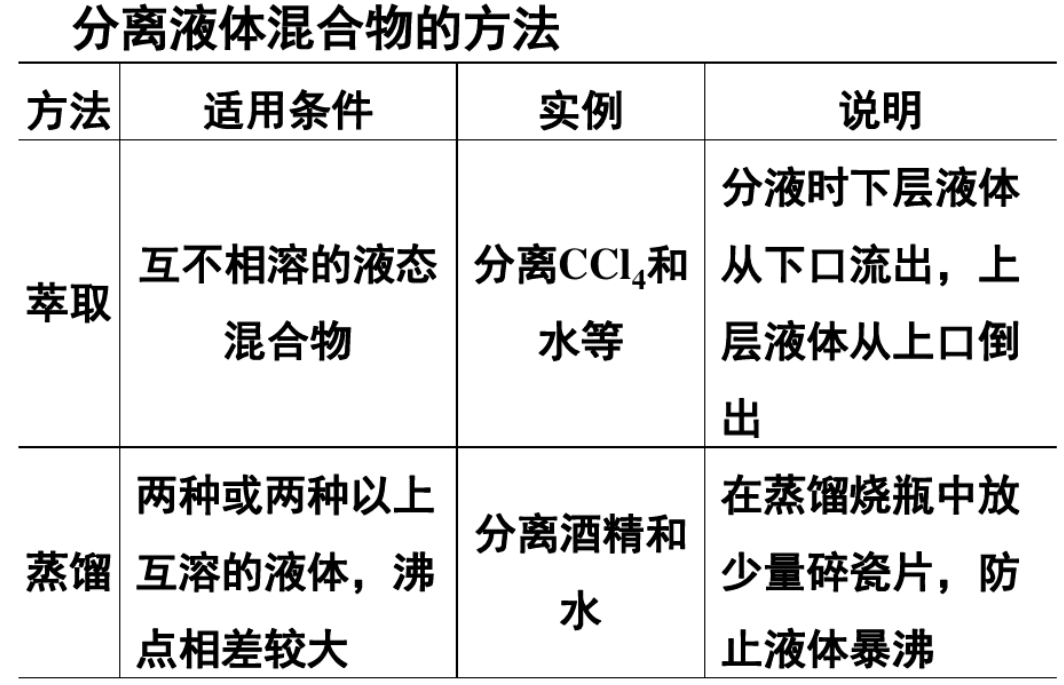
3、根据产品与杂质的性质特点选择合适的分离提纯方法,如蒸馏、分液等。
四、重点关注的操作要点
1、萃取:萃取剂要求溶质在萃取剂中的溶解度大于在原溶剂中的溶解度;萃取剂与原溶剂互不相溶;溶质与萃取剂不反应。
2、分液:下层液体从下口放出,上层液体从上口倒出。
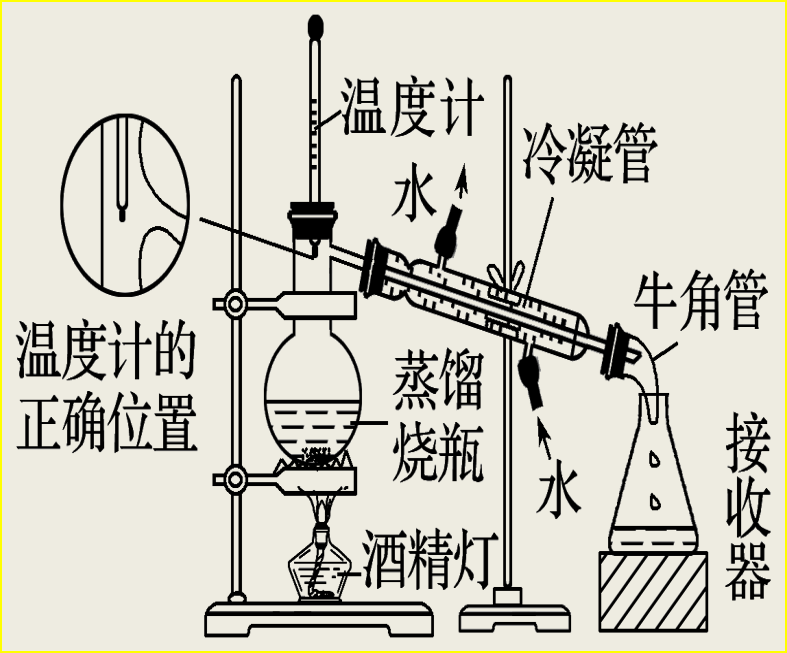
3、蒸馏:需加沸石防止暴沸;温度计的水银球在蒸馏烧瓶的支管口处;冷凝水从冷凝管下口进上口出。(两种或两种以上互溶的液体,沸点相差较大,放少量碎瓷片,防止液体暴沸)
4、蒸发结晶:加热过程不断搅拌,以免局部过热 ;较多晶体析出时停止加热,利用余热把剩余水蒸干。
5、蒸发浓缩:加热至溶液表面出现晶膜为止。
6、过滤:“一贴二低三靠”,滤纸紧贴漏斗内壁,滤纸低于漏斗边缘,液面低于滤纸边缘,上烧杯口紧靠玻棒,玻棒末端紧靠三层滤纸处,漏斗末端紧靠下烧杯内壁
7、减压过滤(也称抽滤或吸滤):安全瓶的作用是防止倒吸,导管应短进长出;布氏漏斗的颈口斜面与吸滤瓶的支管口相对;停止吸滤时,先拆下连接抽气泵和吸滤瓶的橡皮管,然后关闭水龙头,以防倒吸;不宜用于过滤胶状沉淀或颗粒太小的沉淀。
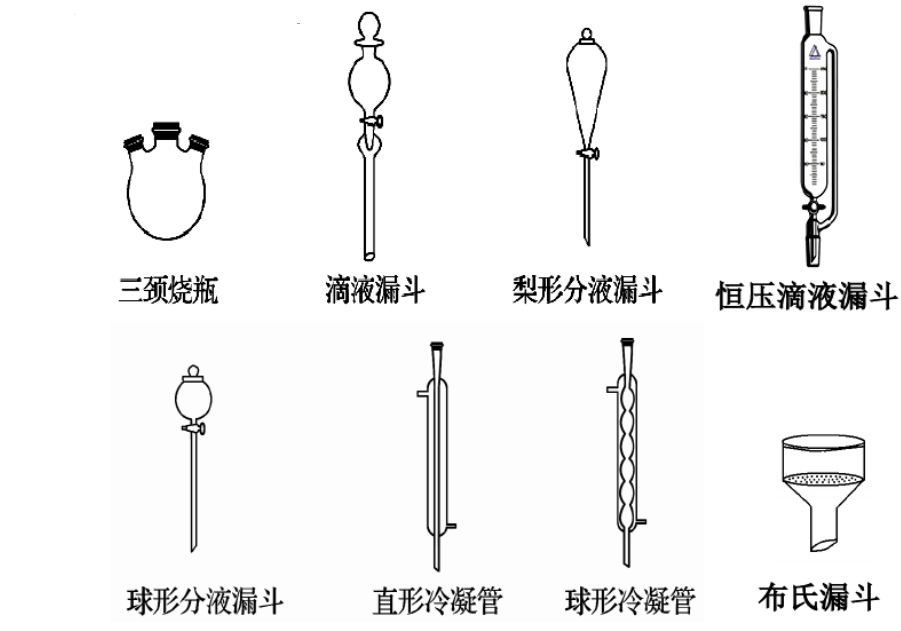
五、盘点常用仪器及装置
1、常用仪器
2、典型装置
①反应装置
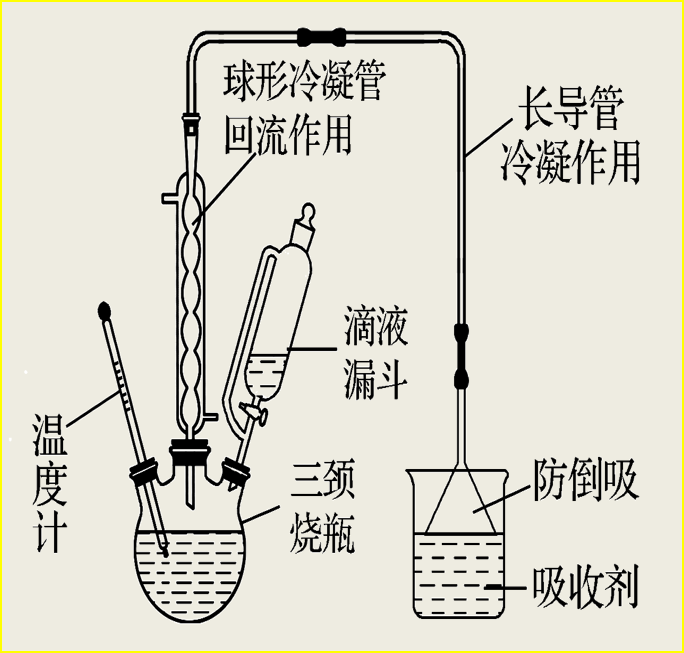
②蒸馏装置
③抽滤装置
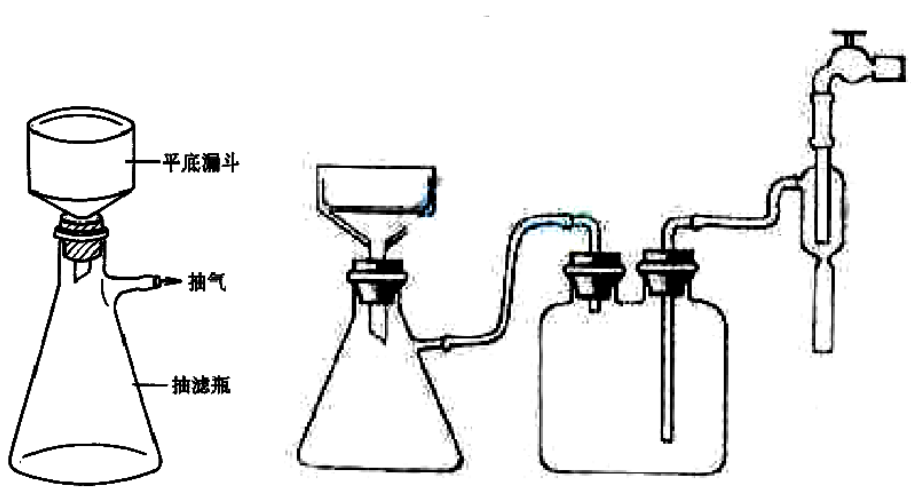
减压过滤(也称抽滤或吸滤):安全瓶的作用是防止倒吸,导管应短进长出;布氏漏斗的颈口斜面与吸滤瓶的支管口相对;停止吸滤时,先拆下连接抽气泵和吸滤瓶的橡皮管,然后关闭水龙头,以防倒吸;不宜用于过滤胶状沉淀或颗粒太小的沉淀
④高考真题中出现的实验装置
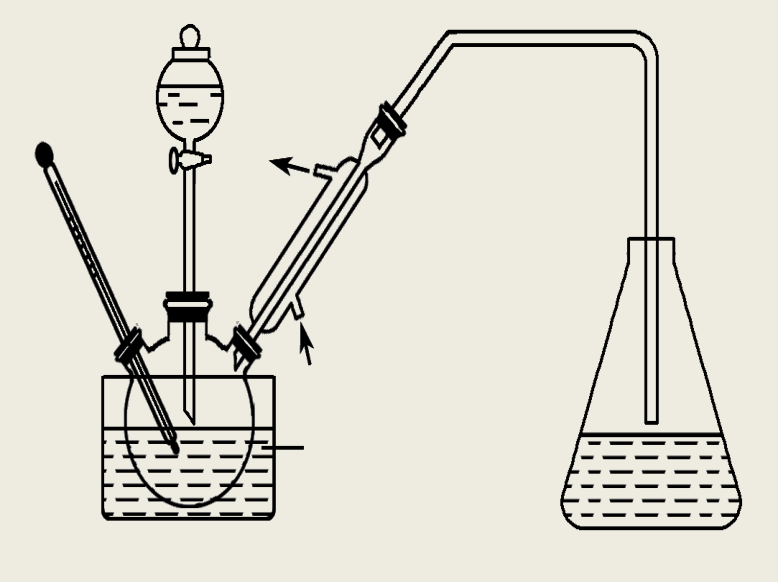
![]()
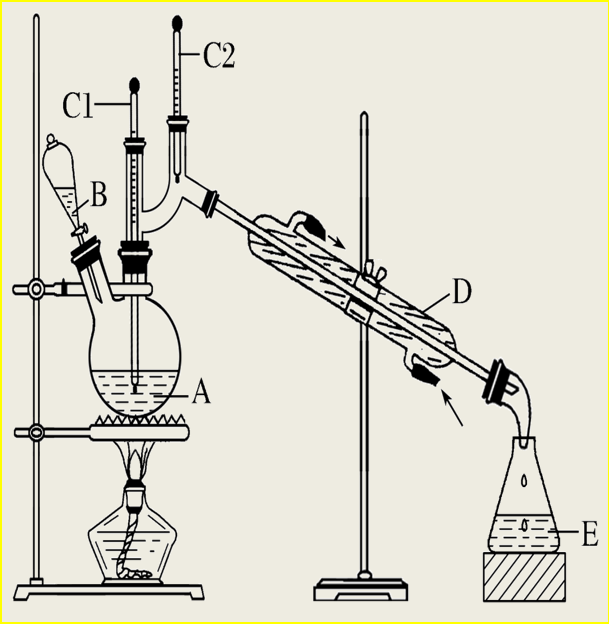
特别提醒: 球形冷凝管由于气体与冷凝水接触时间长,具有较好的冷凝效果,但必须竖直放置防止积液,所以蒸馏装置必须用直形冷凝管。
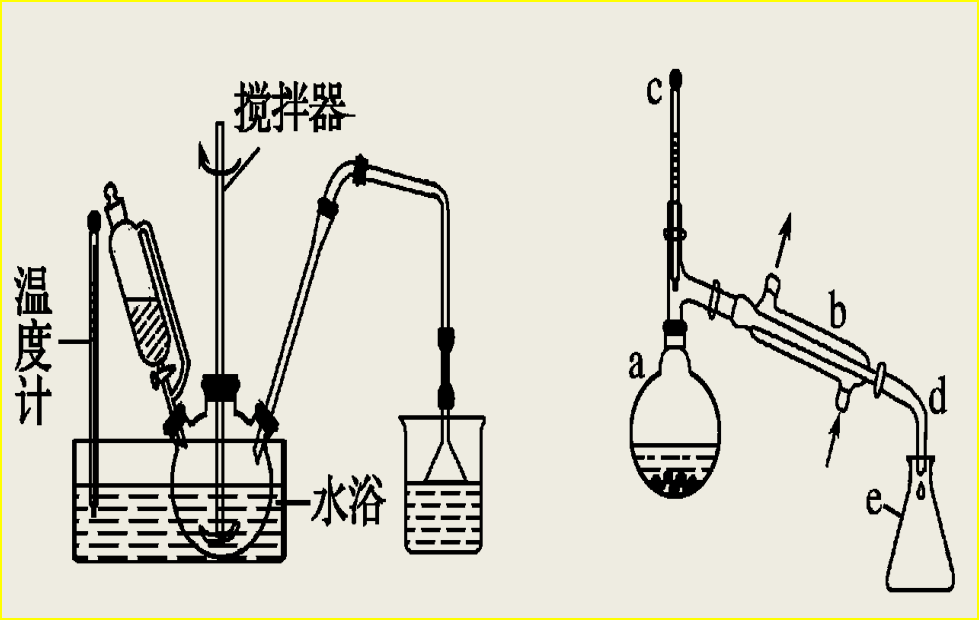
⑤模拟题中出现过的蒸馏、冷凝装置或仪器
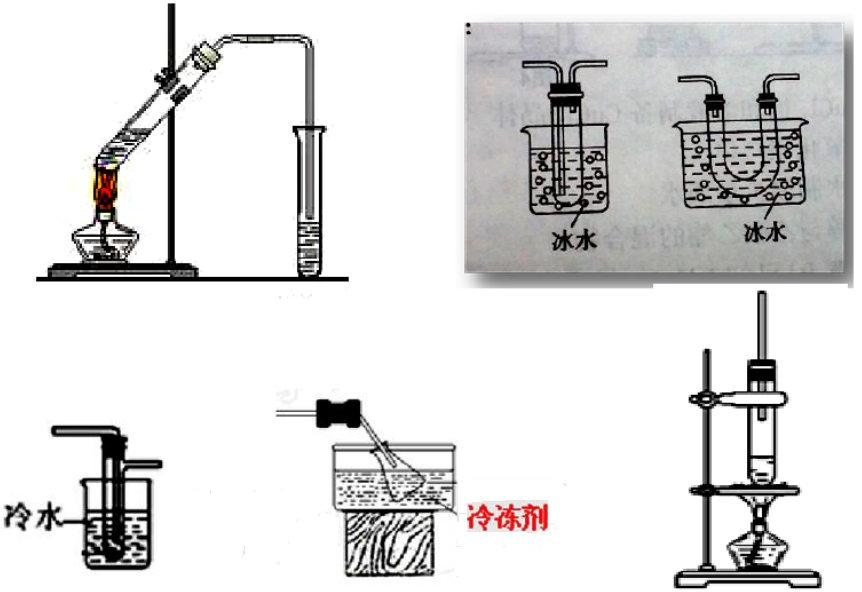
⑥教材中出现过的蒸馏、冷凝装置或仪器

六、熟悉课本实验
1、制乙烯、烯烃
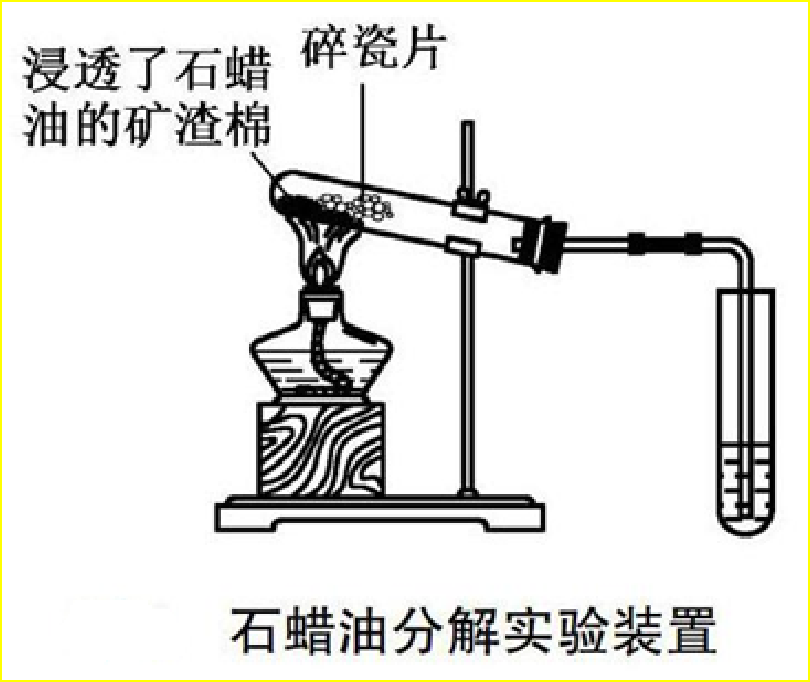
2、苯的溴代反应(选修5,P37)(性质)
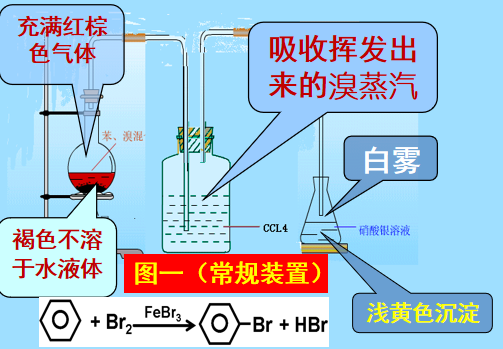
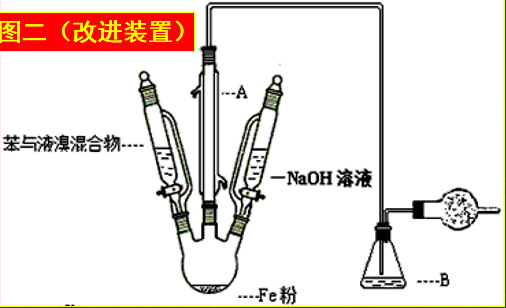
1.Fe屑的作用:与溴反应生成催化剂FeBr3
2.长而直导管的作用:用于导气和冷凝回流。
3.导管末端不能插入液面下的原因:溴化氢易溶于水,防止倒吸。
4.说明发生了取代反应现象而不是加成反应:苯与溴反应生成溴苯的同时有溴化氢生成,说明它们发生了取代反应而非加成反应。因加成反应不会生成溴化氢。
5.纯净的溴苯应是无色的,而所得粗溴苯为褐色,怎样提纯?
因为未发生反应的溴和反应中的催化剂FeBr3溶解在生成的溴苯中。用水和碱溶液反复洗涤可以使褐色褪去,得到纯净的溴苯。
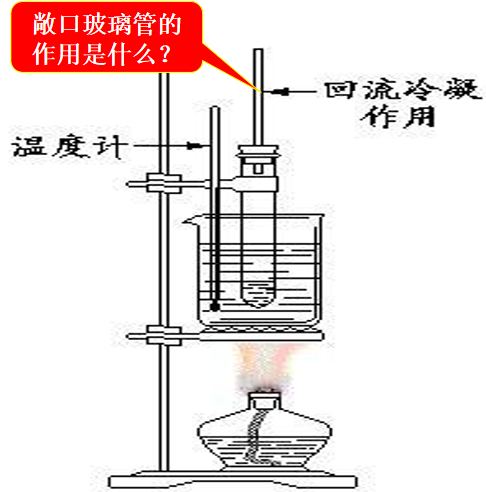
3、苯的硝化反应(选修5,P37)(性质)
反应的化学方程式:
![]()
苯的硝化实验中的问题:
①浓硫酸的作用:催化剂、吸水剂
②配制混合酸时,要将浓硫酸慢慢倒入浓硝酸中,并不断搅拌。以减少浓硝酸的挥发与分解。
③本实验采用水浴加热,温度计的水银球必须插入水浴中。“浴热”容易控制恒温,且易使被加热物受热均匀。
④使用带长导管的玻璃管,目的是使挥发出的反应物得到冷凝并使其流回到反应管中——冷凝回流。(硝基苯的沸点:216.8℃)
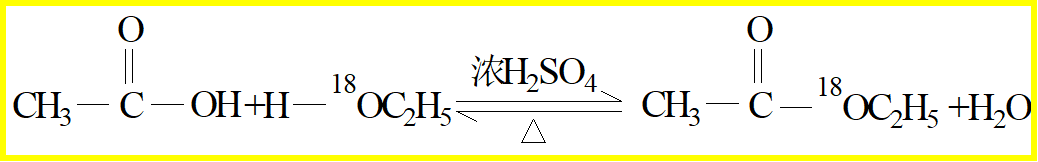
4、乙酸的酯化反应 / 乙酸乙酯的制备(必修2,P75)(选修5,P63)(性质,制备,重点)
1、原料:乙醇、乙酸、浓H2SO4、饱和Na2CO3溶液
2、反应原理
3、装置:
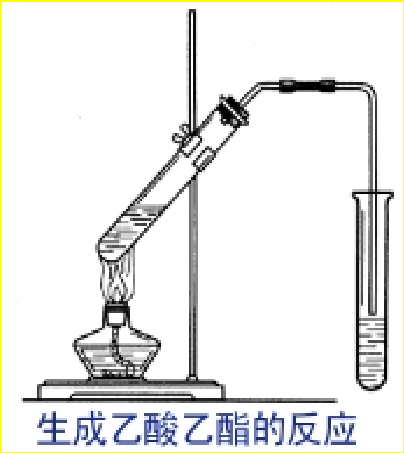
4、 弯曲导管的作用如何? 导气兼冷凝回流(乙酸和乙醇)
5、为什么导管口不能伸入Na2CO3溶液中?防止倒吸.
6、浓硫酸的作用如何? 催化剂和吸水剂
7、饱和Na2CO3溶液的作用如何?
a、乙酸乙酯在饱和碳酸钠溶液中的溶解度最小,利于分层;
b、乙酸与Na2CO3反应,生成无味的CH3COONa而被除去;
c、C2H5OH被Na2CO3溶液吸收,便于除去乙酸及乙醇气味的干扰。
8、从化学平衡移动原理思考提高乙酸乙酯的产率的措施?
(1)增大反应物浓度:使用过量乙醇
(2)减小生成物浓度:蒸出乙酸乙酯
(3)升温:加热
(4)浓硫酸做催化剂、吸水剂
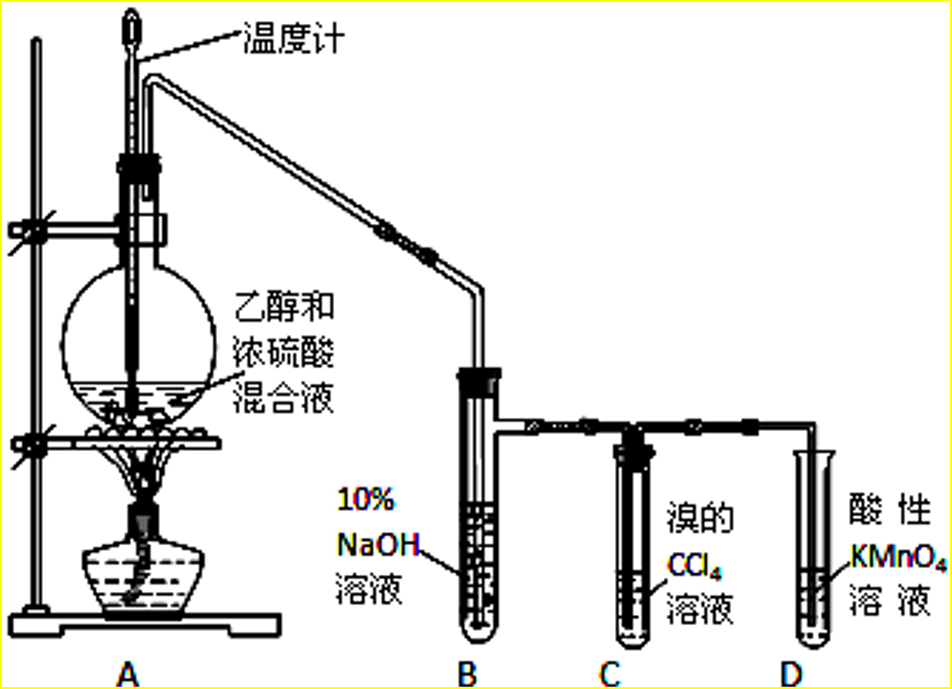
5、 制乙烯实验装置
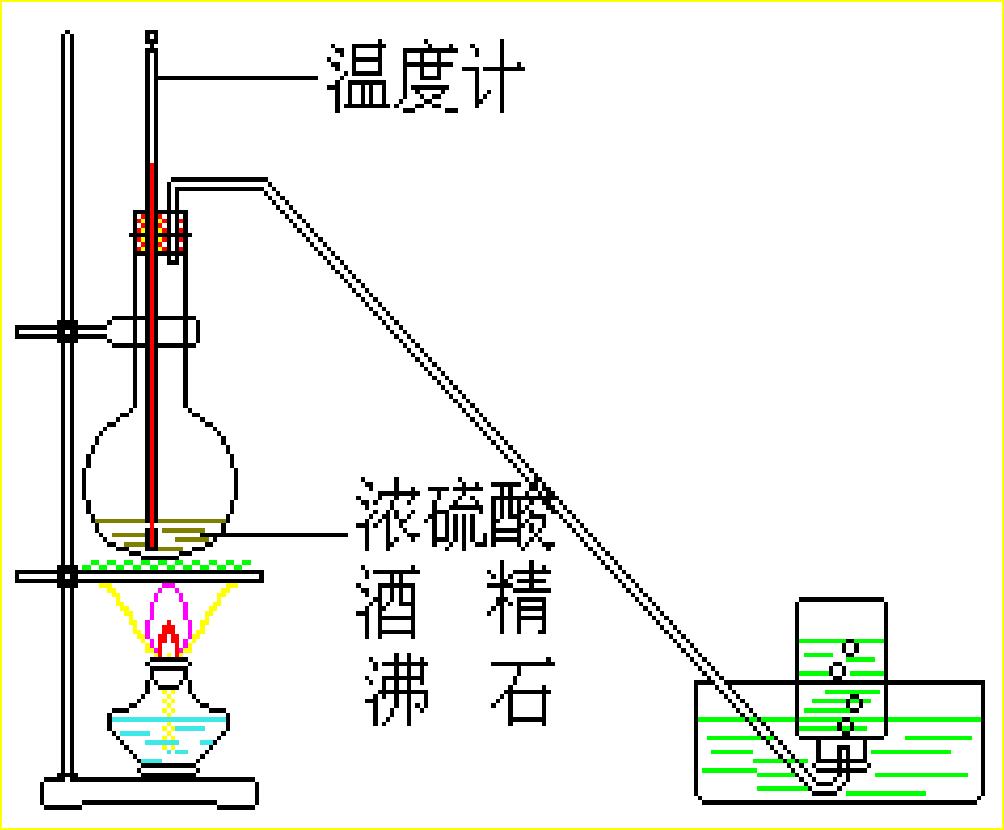
1、放入几片碎瓷片作用是什么?防止暴沸
2、浓硫酸的作用是什么?催化剂和脱水剂
3、酒精与浓硫酸体积比为何要为1∶3?
因为浓硫酸是催化剂和脱水剂,为了保证有足够的脱水性,硫酸要用98%的浓硫酸,酒精要用无水酒精,酒精与浓硫酸体积比以1∶3为宜。
4、温度计的位置?温度计感温泡要置于反应物的中央位置因为需要测量的是反应物的温度。
5、为何使液体温度迅速升到170℃?
因为无水酒精和浓硫酸混合物在170℃的温度下主要生成乙烯和水,而在140℃时乙醇将以另一种方式脱水,即分子间脱水,生成乙醚。
6、混合液颜色如何变化?为什么?
烧瓶中的液体逐渐变黑。因为浓硫酸有多种特性。在加热的条件下,无水酒精和浓硫酸混合物的反应除可生成乙烯等物质以外,浓硫酸还能将无水酒精氧化生成碳的单质等多种物质,碳的单质使烧瓶内的液体带上了黑色。
7、有何杂质气体?如何除去?
由于无水酒精和浓硫酸发生的氧化还原反应,反应制得的乙烯中往往混有CO2、SO2等气体。可将气体通过氢氧化钠溶液(或碱石灰)。
8、为何可用排水集气法收集?因为乙烯难溶于水。

- 全部评论(0)
