难点十:原子结构与性质中概念的一些细节问题
时间:2021-04-15 10:53 来源:高中化学教学研究 作者:张德金 点击: 次 所属专题: 原子结构03与性质
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、理解核外电子运动状态的决定因素
1、一个核外电子的运动状态由因素决定:能层、能级、轨道、自旋方向。
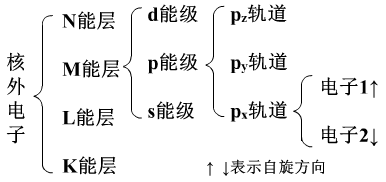
2、各因素的意义:
(1)不同能层上的电子的能量不同,不同能级上的电子能量也不相同。同一能级上的电子,同一轨道上的电子的能量都是相同的。电子首先充满低能量轨道。同一能级上的电子根据需要可以在不同轨道上重排。
(2)轨道是指的电子的空间运动状态,也就是电子所处的空间,它决定了键的方向和分子的构型。
(3)原子中的电子跃迁与电子所在的能级变化有关,能产生可见光等能量释放或吸收。
(4)电子的填充顺序并不只是按能层填充,而是按构造原理和能量最低原理依次填充。
(5)分析价电子时,也是按能级的填充情况来分析,不是按能层来分析。
(6)分析轨道杂化、离域π键、配位键时,主要分析的是轨道填充情况。
(7)泡利原理决定了共用电子对的形成。
(8)洪特规则也许与杂化有关。
二、注意构造原理与能量最低原理的区别。
构造原理与能量最低原理很相近,在很多地方也是一致的。
但对于第四周期的Cr和Cu,它们的电子排布不完全符合构造原理。它们的电子排布为[Ar]3d54s1和[Ar] 3d104s1,而不是为[Ar]3d44s2和[Ar] 3d94s2。但这种电子排布一定是符合能量最低原理的。(半充满或全充满能量更低)
所以有个别原子的核外电子排布若不符合构造原理,那一定符合能量最低原理。
三、注意电子的空间运动状态与电子的运动状态之间的区别
电子的空间运动状态,是指电子所在的轨道,也就是能级中的2px或3dxy等轨道。
电子的运动状态,除了指电子所在的轨道外,还包括电子的自旋方向。例如某电子的运动状态是在4Pz轨道中进行正向自旋。
原子核外的每个电子的运动状态是唯一的。电子的空间运动状态,最多有两个是相同的。
四、构造原理、能量最低原理、泡利原理、洪特规则之间的关系。
构造原理是能量最低原理、泡利原理、洪特规则的外在表现。
半充满、全充满、全空更稳定,是洪特规则的特例。
能量最低原理、泡利原理、洪特规则,决定了原子的核外电子排布方式,也决定了化学性质。

- 全部评论(0)
