回归课本:高中化学容易忽略的一些知识
时间:2021-05-14 14:07 来源:高中化学教学研究 作者:张德金 点击: 次 所属专题: 易错点
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
必修一
1、阿伏加德罗(A.Avogadro),意大利物理学家,最早提出分子概念,提出了假说(阿伏加德罗定律):在相同的温度和相同压强条件下, 。
阿伏加德罗常数并非由阿伏加德罗测量出或计算出,是人们为了纪念他而定。
2、在粒子数目相同的情况下,物质体积的大小取决于构成物质的 和 。
对于固体和液体而言,主要决定于 。对于气体而言,主要决定于 。
在25℃和101KPa下,气体摩尔体积约为 。
3、写出计算过程计算:配制500mL0·1mol/L NaOH溶液所需的NaOH的质量 :
4、对大量物质进行分类时,要事先设定 。纯净物按元素种类分为单质和化合物,这种分类方法叫 。Na2CO3从阳离子组成上属于钠盐,从阴离子组成上属于碳酸盐,这种分类方法叫 。
5、胶体在稳定性属于介稳体系,比较稳定。原因是胶体粒子带 ,它们之间相互排斥,阻碍了粒子的变大而聚沉。胶体粒子所作的 运动也起到了对聚沉的阻碍作用。
6、Li到Cs金属的密度越来越 ,熔沸点越来越 。
活泼金属、油,着火不能用水灭火,用 。
金在高温下也不与氧气反应。在自然界中常以游离态存在。
镁、铝金属非常活泼,却在生活中应用广泛,原因是表面都有 。
氧化铝可用来制造耐火坩埚、耐火管、耐高温的实验仪器。
氢氧化铝是医用胃酸中和剂中的一种。
铝与硝酸汞反应的方程式为 。
7、我国使用最早的合金是 ,目前用量最大的合金是 。青铜含铜锡(铅)。黄铜含铜锌(锡铅铝)。白铜含铜镍锌(锰)。
碳素钢中含碳量低于 的叫低碳钢,含碳量在0.3%-0.6%之间的叫 ,含碳量高于 的叫高碳钢。
稀土元素共 种,包括镧系元素15种和钇、钪。
黑色金属是指 。其它金属称为有色金属。
8、土壤中的土壤胶体带电,能吸收K+、NH4+等,有保肥能力。
玻璃由 制成。水泥由 烧制后,加 研粉制成。陶瓷由 烧制而成。
硅的化合物的应用: (金刚砂)用作磨料, 作变压器铁芯,耐高温又耐低温的橡胶是 ,分子筛用作吸附剂和催化剂。
粗硅变为纯硅的方法是 , 。
硅酸溶胶、硅酸凝胶、硅酸干凝胶, 是胶体。 是干燥剂。
9、软锰矿的主要成分是 。氯气由瑞典化学家发现,并由英国化学家戴维分析出是一种单质。
漂白粉: 的混合固体。漂白精:主要是 。漂白液: 的混合溶液。
84消毒液的主要成分是 。洁厕灵的主要成分是 。厨房清洁剂是 等。
F2、Cl2、Br2、I2常温下的颜色和状态分别为 、 、 、 。
10、硫:不溶于水,微溶于酒精,易溶于 。
黑火药(一硫二硝三炭)反应为: 。
维生素C又叫抗坏血酸,具有 性。常用作食品添加剂。
SO3在标准状况下是 体,常温下是 体,温度稍高后是 体。
11、NO2在标准状况下是 体,常温下是 体。
正常雨水pH为。酸雨主要是由 的氧化物和 的氧化物导致。
HNO3与不同物质或在不同条件下,生成产物的价态不同。+3价的产物一般是HNO2或NO2-。+1价的产物一般是N2O。
德国化学家哈伯因为在 方面的巨大贡献,获得诺贝尔奖。
用浓氨水检查氯气管道是否漏气,方程式为 。现象为有白烟生成。
必修二
1、 国化学家门捷列夫(Mendeleyev)制出了第一张元素周期表。
考古用 测定文物的年代,氢弹用 制造,原子弹由 制造。(同位素)
2、高炉炼铁的反应: 。
火法炼铜的反应: 。
湿法炼铜的反应: 。
Ag2O和HgO受热会分解为金属。化学方程式为: , 。
所以这两种金属能用 法冶炼。
需要用电解法炼的金属有 等。
3、海水淡化的方法主要有蒸馏法、 法、 法。
4、海水中除H、O外,主要有 、 、 、 、Ca、S、C、F、B、Br、Sr等,其他为微量元素。
5、石油中有 和 。常压蒸馏得到石油气、 、 、 。减压蒸馏得到、石蜡、燃料油、 等。裂化得到,裂解得到气态 。催化重整得到 。
6、煤可以干馏得出炉煤气、煤焦油、 ,煤焦油可以得到 。煤的气化是指与水反应生成 。煤的间接液化是指煤气化后将CO和H2反应合成甲醇等。煤的直接液化是指煤与氢气反应生成液体燃料。
7、环境问题,主要是指 , 。
8、绿色化学的核心就是 。
最理想的“原子经济”就是反应物全部转化为期望的最终产物,原子利用率为 。
9、乙烯与氯水的反应: 。
然后再加入Ca(OH)2的反应为 。
乙烯在银催化下与氧气的反应为 。
选修四
1、并不是所有的化学反应都要先断键再成键。
热化学方程式要标注反应的 。如果不标注,默认为 。
反应在 条件下的热效应等于焓变。
有些活化能接近于0的反应,如Ag+与Cl-的反应,此反应温度对反应速率影响 (很大或很小)。
写出氢气还原氧化钨的反应,此反应是 热反应。
用ΔH和ΔS解释化学反应的自发性,当ΔH 0且ΔS 0时,高温自发。
2、指示剂的变色范围:甲基橙 ,颜色为红-橙-黄。
石蕊 ,颜色为红-紫-蓝。
酚酞 ,颜色为无-浅红-红。
强酸弱碱滴定时指示剂用,强碱弱酸滴定时指示剂用 。
3、H3BO3是 元酸,比碳酸弱,电离方程式为: 。
H3BO3与NaOH的化学方程式为 。
4、NaHCO3溶液显 性,NaHSO3溶液显 性,CH3COONH4溶液显 性。
5、盖斯定律中的盖斯(G.H.HeSS)是俄国化学家。勒夏特列原理中的勒夏特列(H.Lechatelier)是法国化学家。
6、阿累尼乌斯是瑞典物理化学家,创立了理论,即电解质电离为离子不需要在电的作用下。他还提出了阿累尼乌斯公式(反应速率常数计算公式)K=Ae-Ea/RT。
7、SOCl2是一种液态化合物,遇水会强烈水解,反应方程式为 。将AlCl3·6H2O与SOCl2混合并加热,可得到。
8、K> 时,反应基本就完全了。
溶解度小于 叫难溶。
离子浓度小于 时,就认为沉淀完全。
9、碱性锌锰电池的总反应 。
锌银电池的总反应为 。
铅蓄电池的总反应为 。
镉镍可充电电池的总反应为 。
电化学防护包括 法和 法。
选修五
1、碳元素能形成庞大的有机物家族的原因与碳原子的 和碳原子的 有关。
荷兰物理化学家范霍夫(Van't Hff)提出碳价四面体学说。
2、有机反应与无机反应相比的特点:反应速率 ,反应产物 ,反应常在 溶剂中进行。
3、苯是英国科学家 首先发现的。德国科学家米希尔里希命名为苯,法国化学家热拉尔确定了相对分子质量为78,分子式为C6H6。德国化学家 确定了结构式。
4、李比希法是有机物的元素定量分析方法,利用与烃或烃的含氧衍生物反应,将生成的H2O用 吸收,CO2用 溶液吸收,并进行测量和计算。
5、对被蒸馏物的要求是 ,稳定性,与另一物质的沸点相差 (一般约大于30℃)。
稳定性稍差的可以采用 蒸馏。沸点相差较小的可以采用分级蒸馏装置(如维氏蒸馏柱)。
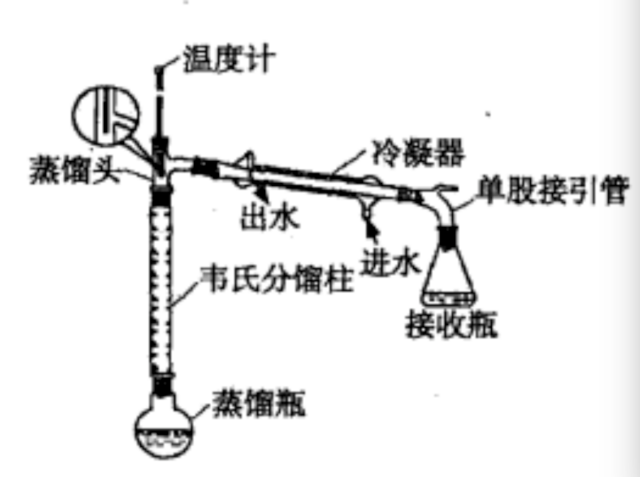
共沸混合物 能直接用蒸馏分离,一般采用化学反应转化后蒸馏分离。
沸石为什么能防止暴沸: .
6、带难溶杂质的苯甲酸的重结晶步骤:加热溶解,用趁热过滤,冷却结晶,过滤。
苯甲酸和苯甲酸钠都是食品防腐剂。
7、苯酚又叫石炭酸。有腐蚀性,沾皮肤后立即用洗涤。
8、硬肥皂是指 ,软肥皂指 。肥皂的去污原理:憎水基溶入油污,亲水基溶于水,形成乳浊液。
赤潮与水华现象与洗涤剂和肥料中的 有关。
生物柴油是指 。
9、葡萄糖分子结构简式为。果糖分子结构简式为 。
葡萄糖变乳酸的反应: 。
葡萄糖变酒精的反应: 。
10、结构简式:甘氨酸 、丙氨酸 、苯丙氨酸 、谷氨酸 。
11、核酸是一类含磷的生物高分子化合物,由磷酸、 、碱基结合而成的。
12、有机玻璃的合成方程式:
n CH2=C(CH3)-COOCH3→-[-CH2=C(CH3)(COOCH3)-]n-。
13、合成高分子材料: 、 、 、黏合剂、涂料等。
功能高分子材料:高分子分离膜、液晶高分子、导电高分子、医用高分子、高吸水性树脂。
14、合成高分子结构大致可以分三类:型结构、型结构、结构。线型结构、支链型结构主要对应塑料,网状结构主要对应塑料。
15、涤纶、锦纶、腈纶、丙纶、维纶、氯纶被称为“六大纶”。
又叫人造棉花,有很好的吸湿性,因为分子链上有羟基。
锦纶-66的合成方程式:
n C(CH2)4COOH+n H2N(CH2)6NH2→ 。
涤纶的合成方程式:
n HOOC-C6H4-COOH+n HOOCH2CH2OH→ 。
16、丁苯橡胶、顺丁橡胶、 排前三。
合成天然橡胶的合成方程式:
nCH2=C(CH3)-CH=CH2→(顺式聚异戊二烯)。
杜仲胶: 。
答案:
必修一
1、阿伏加德罗(A.Avogadro),意大利物理学家,最早提出分子概念,提出了假说(阿伏加德罗定律):在相同的温度和相同压强条件下,相同体积中的任何气体具有相同的分子个数。
阿伏加德罗常数并非由阿伏加德罗测量出或计算出,是人们为了纪念他而定。
2、在粒子数目相同的情况下,物质体积的大小取决于构成物质的粒子的大小和粒子之间的距离。
对于固体和液体而言,主要决定于粒子的大小。对于气体而言,主要决定于粒子之间的距离。
在25℃和101KPa下,气体摩尔体积约为24.5L/mol。
3、写出计算过程计算:配制500mL0·1mol/L NaOH溶液所需的NaOH的质量:
m(NaOH)=n(NaOH)·M(NaOH)=c(NaOH)·V[NaOH(aq)]·M(NaOH)=0.1mol/L×0.5L×40g/mol=2g
4、对大量物质进行分类时,要事先设定标准。纯净物按元素种类分为单质和化合物,这种分类方法叫树状分类法。Na2CO3从阳离子组成上属于钠盐,从阴离子组成上属于碳酸盐,这种分类方法叫交叉分类法。
5、胶体在稳定性属于介稳体系,比较稳定。原因是胶体粒子带同种电荷,它们之间相互排斥,阻碍了粒子的变大而聚沉。胶体粒子所作的布朗运动也起到了对聚沉的阻碍作用。
6、Li到Cs金属的密度越来越大,熔沸点越来越低。
活泼金属、油,着火不能用水灭火,用沙土。
金在高温下也不与氧气反应。在自然界中常以游离态存在。
镁、铝金属非常活泼,却在生活中应用广泛,原因是表面都有一层致密氧化膜。
氧化铝可用来制造耐火坩埚、耐火管、耐高温的实验仪器。
氢氧化铝是医用胃酸中和剂中的一种。
铝与硝酸汞反应的方程式为2Al+3Hg(NO3)2=2Al(NO3)3+3Hg。
7、我国使用最早的合金是青铜,目前用量最大的合金是钢。青铜含铜锡(铅)。黄铜含铜锌(锡铅铝)。白铜含铜镍锌(锰)。
碳素钢中含碳量低于0.3%的叫低碳钢,含碳量在0.3%-0.6%之间的叫中碳钢,含碳量高于0.6%的叫高碳钢。
稀土元素共17种,包括镧系元素15种和钇、钪。8、
黑色金属是指铁、铬、锰。其它金属称为有色金属。
8、土壤中的土壤胶体带负电,能吸收K+、NH4+等,有保肥能力。
玻璃由纯碱、石灰石、石英制成。水泥由黏土、石灰石烧制后,加石膏研粉制成。陶瓷由黏土烧制而成。
硅的化合物的应用:SiC(金刚砂)用作磨料,硅钢作变压器铁芯,耐高温又耐低温的橡胶是硅橡胶,分子筛用作吸附剂和催化剂。
粗硅变为纯硅的方法是Si+2Cl2=高温=SiCl4,SiCl4+2H2=高温=Si+4HCl。
硅酸溶胶、硅酸凝胶、硅酸干凝胶,硅酸溶胶是胶体。硅酸干凝胶是干燥剂。
9、软锰矿的主要成分是MnO2。氯气由瑞典化学家舍勒发现,并由英国化学家戴维分析出是一种单质。
漂白粉:Ca(ClO)2和CaCl2的混合固体。漂白精:主要是Ca(ClO)2。漂白液:NaClO和NaCl的混合溶液。
84消毒液的主要成分是NaClO。洁厕灵的主要成分是HCl。厨房清洁剂是Na2CO3等。
F2、Cl2、Br2、I2常温下的颜色和状态分别为淡黄绿色气体、黄绿色气体、深红棕色液体、紫黑色固体。
10、硫:不溶于水,微溶于酒精,易溶于CS2。
黑火药(一硫二硝三炭)反应为:S+2KNO3+3C=K2S+N2↑+3CO2↑。
维生素C又叫抗坏血酸,具有还原性。常用作食品添加剂。
SO3在标准状况下是固体,常温下是液体,温度稍高后是气体。
11、NO2在标准状况下是液体,常温下是气体。
正常雨水pH为5.6。酸雨主要是由硫的氧化物和氮的氧化物导致。
HNO3与不同物质或在不同条件下,生成产物的价态不同。+3价的产物一般是HNO2或NO2-。+1价的产物一般是N2O。
德国化学家哈伯因为在合成氨方面的巨大贡献,获得诺贝尔奖。
用浓氨水检查氯气管道是否漏气,方程式为8NH3+3Cl2=6NH4Cl+N2。现象为有白烟生成。
必修二
1、俄国化学家门捷列夫(Mendeleyev)制出了第一张元素周期表。
考古用14C测定文物的年代,氢弹用2H、3H制造,原子弹由235U制造。
2、高炉炼铁的反应:Fe2O3+3CO=高温=2Fe+3CO2。
火法炼铜的反应:CuS2+2O2=高温=Cu+2SO2。
湿法炼铜的反应:Fe+CuSO4=FeSO4+Cu。
Ag2O和HgO受热会分解为金属。化学方程式为:
2Ag2O=Δ=4Ag+O2↑,2HgO=Δ=2Hg+O2↑。
所以这两种金属能用热分解法冶炼。
需要用电解法炼的金属有K、Ca、Na、Mg、Al等。
3、海水淡化的方法主要有蒸馏法、电渗析法、离子交换法。
4、海水中除H、O外,主要有Cl、Na、K、Mg、Ca、S、C、F、B、Br、Sr等,其他为微量元素。
5、石油中有烷烃和环烷烃。常压蒸馏得到石油气、汽油、煤油、柴油。减压蒸馏得到润滑油、石蜡、燃料油、沥青等。裂化得到轻质油,裂解得到气态烯烃。催化重整得到芳香烃。
6、煤可以干馏得出炉煤气、煤焦油、焦炭,煤焦油可以得芳香烃。煤的气化是指与水反应生成CO和H2。煤的间接液化是指煤气化后将CO和H2反应合成甲醇等。煤的直接液化是指煤与氢气反应生成液体燃料。
7、环境问题,主要是指人类不合理的开发和利用自然资源所造成的生态环境破坏,以及工农业生产及人类生活所造成的环境污染。
8、绿色化学的核心就是利用化学原理从源头上减少或消除工业生产对环境的污染。
最理想的“原子经济”就是反应物全部转化为期望的最终产物,原子利用率为100%。
9、乙烯与氯水的反应:CH2=CH2+Cl2+H2O→CH2Cl-CH2OH+HCl。
然后再加入Ca(OH)2的反应为2CH2Cl-CH2OH+Ca(OH)2→2CH2/O\CH2(环氧乙烷)+CaCl2+2H2O。
乙烯在银催化下与氧气的反应为CH2=CH2+O2→2CH2/O\CH2(环氧乙烷)。
选修四
1、并不是所有的化学反应都要先断键再成键。
热化学方程式要标注反应的温度和压强。如果不标注,默认为常温常压。
反应在恒压条件下的热效应等于焓变。
有些活化能接近于0的反应,如Ag+与Cl-的反应,此反应温度对反应速率影响很小(很大或很小)。
写出氢气还原氧化钨的反应3H2+WO3=高温=W+3H2O,此反应是吸热反应。
用ΔH和ΔS解释化学反应的自发性,当ΔH>0且ΔS>0时,高温自发。
2、指示剂的变色范围:甲基橙3.1-4.4,颜色为红-橙-黄。
石蕊5-8,颜色为红-紫-蓝。
酚酞8.2-10,颜色为无-浅红-红。
强酸弱碱滴定时指示剂用甲基橙,强碱弱酸滴定时指示剂用酚酞。
3、H3BO3是一元酸,比碳酸弱,电离方程式为:H3BO3+H2O⇌H++B(OH)4-。
H3BO3与NaOH的化学方程式为NaOH+H3BO3=NaB(OH)4。
4、NaHCO3溶液显碱性,NaHSO3溶液显酸性,CH3COONH4溶液显中性。
5、盖斯定律中的盖斯(G.H.HeSS)是俄国化学家。勒夏特列原理中的勒夏特列(H.LECHATELiEr)是法国化学家。
6、阿累尼乌斯是瑞典物理化学家,创立了电离理论,即电解质电离为离子不需要在电的作用下。他还提出了阿累尼乌斯公式(反应速率常数计算公式)K=Ae-Ea/RT。
7、SOCl2是一种液态化合物,遇水会强烈水解,反应方程式为SOCl2+H2O=2HCl↑+SO2↑。将AlCl3·6H2O与SOCl2混合并加热,可得到无水AlCl3。
8、K>1×105时,反应基本就完全了。
溶解度小于0.01g 叫难溶。
离子浓度小于1×10-5mol/L 时,就认为沉淀完全。
9、碱性锌锰电池的总反应为Zn+2MnO2+2H2O=Zn(OH)2+2MnO(OH)。
锌银电池的总反应为Zn+Ag2O+H2O=Zn(OH)2+2Ag。
铅蓄电池的总反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O。
镉镍可充电电池的总反应为Cd+2NiO(OH)+2H2O=Cd(OH)2+2Ni(OH)2。
电化学防护包括牺牲阳极的阴极保护法和外加电流的阴极保护法。
选修五
1、碳元素能形成庞大的有机物家族的原因与碳原子的成键特点和碳原子的结合方式有关。
荷兰物理化学家范霍夫(VAN'T HFF)提出碳价四面体学说。
2、有机反应与无机反应相比的特点:反应速率缓慢,反应产物复杂,反应常在有机溶剂中进行。
3、苯是英国科学家法拉弟首先发现的。德国科学家米希尔里希命名为苯,法国化学家热拉尔确定了相对分子质量为78,分子式为C6H6。德国化学家凯库勒确定了结构式。
4、李比希法是有机物的元素定量分析方法,利用CuO与烃或烃的含氧衍生物反应,将生成的H2O用无水CaCl2吸收,CO2用浓KOH溶液吸收,并进行测量和计算。
5、对被蒸馏物的要求是,稳定性较强,与另一物质的沸点相差较大(一般约大于30℃)。
稳定性稍差的可以采用减压蒸馏。沸点相差较小的可以采用分级蒸馏装置(如维氏蒸馏柱)。
共沸混合物不能直接用蒸馏分离,一般采用化学反应转化后蒸馏分离。
沸石为什么能防止暴沸:沸石微孔中的气体受热产生气泡,使液体平稳沸腾。
6、带难溶杂质的苯甲酸的重结晶步骤:加热溶解,用短颈漏斗趁热过滤,冷却结晶,过滤。
苯甲酸和苯甲酸钠都是食品防腐剂。
7、苯酚又叫石炭酸。有腐蚀性,沾皮肤后立即用酒精洗涤。
8、硬肥皂是指钠肥皂,软肥皂指钾肥皂。肥皂的去污原理:憎水基溶入油污,亲水基溶于水,形成乳浊液。
赤潮与水华现象与洗涤剂和肥料中的磷酸盐有关。
生物柴油是指高级脂肪酸甲酯或乙酯。
9、葡萄糖分子结构简式为CH2OH(COOH)4CHO。果糖分子结构简式为CH2OH(COOH)3COCH2OH。
葡萄糖变乳酸的反应:C6H12O6(葡萄糖)→乳酸菌→2CH3CHOHCOOH。
葡萄糖变酒精的反应:C6H12O6(葡萄糖)→酒化酶→2CH3CH2OH+2CO2↑。
10、结构简式:甘氨酸H2NCH2COOH、丙氨酸CH3CH(NH2)COOH、苯丙氨酸C6H5CH2CH(NH2)COOH、谷氨酸HOOCCH2CH2CH(NH2)COOH。
11、核酸是一类含磷的生物高分子化合物,由磷酸、戊糖、碱基结合而成的。
12、有机玻璃的合成方程式:n CH2=C(CH3)-COOCH3→-[-CH2=C(CH3)(COOCH3)-]n-。
13、合成高分子材料:塑料、合成纤维、合成橡胶、黏合剂、涂料等。
功能高分子材料:高分子分离膜、液晶高分子、导电高分子、医用高分子、高吸水性树脂。
14、合成高分子结构大致可以分三类:线型结构、支链型结构、网状结构。线型结构、支链型结构主要对应热塑性塑料,网状结构主要对应热固性塑料。
15、涤纶、锦纶、腈纶、丙纶、维纶、氯纶被称为“六大纶”。
维纶又叫人造棉花,有很好的吸湿性,因为分子链上有羟基。
锦纶-66的合成方程式:
C(CH2)4COOH+nH2N(CH2)6NH2→HO-[-OC(CH2)4CO-HN(CH2)6NH-]n-H+(2n-1)H2O。
涤纶的合成方程式:
n HOOC-C6H4-COOH+n HOOCH2CH2OH→HO-[-OC-C6H4-CO-OCH2CH2O-]n-H+(2n-1)H2O。
16、丁苯橡胶、顺丁橡胶、合成天然橡胶排前三。
合成天然橡胶的合成方程式:
nCH2=C(CH3)-CH=CH2→-[-CH2-C(CH3)=CH-CH2-]n-(顺式聚异戊二烯)。
杜仲胶:反式聚异戊二烯。

- 全部评论(0)
