关于化学符号及其组合的教学思考
时间:2021-08-22 12:07 来源:未知 作者:赵庆生 点击: 次 所属专题: 化学符号
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
前言:有教学研究群中老师提出,电极反应式中的气体和沉淀的符号是否需要标记?这一问题涉及到化学符号-化学用语的四个方面即:分类;每条用语的表征;学生失误分析;复习建议。弄清这四个之后,是否需要标记的问题会不言自明。
化学符号及其组合是化学的学科语言重要组成部分,可分为微粒表征式和微粒变化式两类,它们是学习化学的基础。所以非常重要,特别是表示微粒变化的一系列方程式,是掌握物质化学性质的必由之路,而且还是高考每卷必考内容,占有相当大的权重。本文在微粒表征式一类选电子式,从上述四个方面进行说明,提出学习掌握这部分化学基础知识的方法和步骤。微粒变化一类以离子方程式请见离子反应一文。
一、化学符号-化学用语的分类 。
1、微粒表征式 表征微粒本身,但不表示微粒的变化。如元素符号、电子式等一系列微粒表示式
2、微粒变化式 由微粒的组合来表示微粒或物质的变化。如以化学反应方程式为代表的一系列方程式
二、化学符号的表征(意义)
电子式是由元素符号(表示原子核和内层电子)和小黑点(最外层电子)表示物质微粒结构的一种化学式。其意义在于:微粒原子核、最外层电子数、最外层电子成对情况、键合(共用或离子)、电性和电荷五条。
三、学生失误分析
2010年7.下列各项表达中正确的是
A. Na2O2的电子式为
Na![]() Na
Na
B.106g 的乙醇和丙醇混合液完全燃烧生成的CO2为112L(标准状况)
C.在氮原子中,质子数为7而中子数不一定为7
D.Cl-的结构示意图为
![]()
本题为选择题,正确答案,为C选项,由于氮元素存在有同位素,因此质子数一定是7,而中子数除7外,还有中子数为8以及其他数目的同位素。a选项涉及电子式,由于过氧化钠是活泼金属与非金属元素形成的化合物,一定是离子化合物,过氧团成为带两个负电荷的阴离子。题目所给没有表现出离子,因此很容易判断该选项叙述错误,不属备选答案。这一知识点在必修2 第一章第三节电子式 。
2015年乙卷一卷27.硼及其化合物在工业上有许多用途。以铁硼矿(主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示:
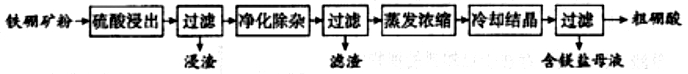
回答下列问题:
第(5)小题要求书写硼氢化钠(NaBH4)的电子式,题目给出了化学式。因为金属化合物一定是离子化合物,特别活泼金属更是如此。这里硼氢化钠阳离子为钠离子Na+,据化合物本身为电中性的原则,剩余部分BH4应当是负一价的阴离子,应当用[BH4]-表示。再分析这一阴离子的内部成键情况。b原子最外层有三个电子,可与3个氢原子形成3个共价单键成为BH3分子(大学化学讲形成B2H6分子,这里不细讲),可以考虑氢负离子H-带着一对电子与BH3分子结合,就像氨分子中氮原子拿出一对电子与质子结合,成为正一价的铵根离子一样,这里是负氢离子带着一对电子与BH3分子形成负一价的硼氢离子。先明确微粒是分子还是离子,这里是两种离子结合而成的离子化合物。再看化学键类型。现有钠离子与硼氢负离子之间的离子键,硼原子与氢原子之间形成的共价键,还有类似铵根离子中的B原子与负氢离子之间结合的一种化学键。类比氨分子中氮原子和氢离子的结合成为铵根离子,这也是共用一对电子。钠原子失去了最外层的一个电子,就直接用阳离子的离子符号表示;阴离子是原子团,属于一个整体,因此要加中括号。阳离子写在左侧,阴离子写在右侧。除这一思路外,这一小题还有两种解答方法。在确定是由钠离子形成的离子化合物之后,一种方法是根据氢为一价,直接写成四个氢原子都与硼原子以共价单键结合,由于氢原子只有1个电子,硼原子有3个价电子,还需要1个电子才能满足,成为负一价的阴离子;再有一种解法是根据选修3物质结构硼原子最外层有2s和2p共4条轨道,其中3条与氢原子成共价单键,一条空轨道接纳氢负离子的一对电子成为配位键,最终四个键相同,成为四面体型的一价阴离子。这两种解法,本人均不赞同。前一种解法完全是猜想,具有很强的盲目性,后一种解法需要用到选修3原子轨道概念,相对于考试大纲属于超纲。本题难度很大,甚至有人认为超纲。主要错误是⑴
阴离子没有加括号,⑵出现氢负离子⑶阴离子电荷多加了数字1,没有略去1这个数字。
2016年甲卷Ⅱ卷26.(14分)
联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。回答下列问题:
(1)联氨分子的电子式为_______
第(1)题考查分子结构:电子式、化合价。根据n(原子最外层)5个电子,H原子最外层一个电子。两种思路书写肼的电子式。一是借鉴C2H6的结构,二是可视为肼是氨分子失去一个氢原子的剩余部分连接。可先写出N2H4的结构式,两个氮原子之间共用一对电子,每个氮原子分别与两个氢原子共用一对电子。这样即可确定其电子式。注意肼分子两个氮原子都有一对孤对电子。本小题较2015年乙卷硼氢化钠电子式题目容易,但仍有超过三分之一的考生回答错误,原因是机械记忆,不会迁移运用。
四、复习建议
1、将化学用语即化学符号及其变化作为化学二轮复习的一个专题,配置相应的简单练习分类理解熟悉。山西大学附中自2005年高三开始这样做,2006年就产生明显成效。
2、明确定义并理解意义 教材有明确定义的,要按照教材去理解记忆。教材没有叙述的如电子式等,要学生自己体会写出,学生水平不及的,也要通过讨论(在最初的教学涉及时)由老师写出。
如电子式定义:由元素符号(表示原子核和内层电子)和小黑点(最外层电子)表示物质微粒结构的一种化学图式。电子式意义最多有五条:微粒原子核、最外层电子数、最外层电子成对情况、键合(共用或离子)、电性和电荷五条。
3、适当练习
电子式练习:教材后面就附有相应练习题,如必修2第一章第三节化学键习题要求写出6种物质氯气、氮气水、甲烷、氯化钾、氯化镁的电子式。还应当拓展到过氧化氢、氯化铵、乙炔等三种分子。
离子方程式练习:从复分解反应到简单氧化还原反应、再到复杂氧化还原反应。
所谓适当有4条:先理解、再练习;严格控质量,切记不能超量;难度控制,以单质铜和稀硝酸反应为最大难度;陌生反应必须给出足够信息。
4、总结方法
总体来讲是从简单到复杂。电子式写法有七步21字:明微粒(分子、原子、离子)、定键型(共用还是得失)、找共用(共用对象、共用电子对数)、外失无(主族金属元素原子全部失去最外层电子成为简单阳离子)、加括号(阴离子加括号是表示得到电子,完全归属;原子团加括号表示多个原子成为一个整体)、同性斥(同种电荷互斥尽可能远离,能量最低)、存在写(不能臆造)21字。更具体的说明见《历年高考真题解析》全国卷 理综化学 光明日报出版社一书,内有22本分册2015年乙卷(Ⅰ卷)分册P20第27题硼氢化钠电子式详解。
赵庆生2020年4月17日于 19:40(美东时间)

- 全部评论(0)
