关于卤素单质化学性质的问题集
时间:2021-10-27 11:09 来源:未知 作者:王笃年 点击: 次 所属专题: 卤族
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1.卤素单质间的相互置换问题
先请大家判断下列说法是否正确。
“如果卤素单质A可以把卤素单质B从其化合物中置换出来,则说明A的氧化性比B强,或者说A的原子序数比B小。”
你的答案是什么?
循着F、Cl、Br、I的顺序,卤素的非金属性减弱,其单质氧化性减弱,而阴离子F-、Cl-、Br-、I-的还原性增强,所以一般说前者可以置换后者的单质。
然而,一些情况下,也会发生后者置换前者的反应。如:
I2+2KBrO3= Br2+2KIO3
显然,不可据此反应判断出I2的氧化性比Br2强。
因为该反应中,跟I2发生反应的不是Br-,而是氧化态为+5的溴元素。该反应中,I2并非氧化剂,而是还原剂,Br2也非氧化产物,而是还原产物。
根据氧化还原反应的基本规律,还原剂的还原性比还原产物要强,也就是说,还原性:I2> Br2,这跟氧化性Br2> I2并不矛盾。
2.碘跟淀粉作用的有关问题
碘单质遇淀粉的水溶液可以呈现出特殊的蓝色,这一特性常常用来检验碘或淀粉的存在。与此实验有关的问题很多。
(1)反应的原理是怎样的?化学方程式咋写?
据研究,碘的水溶液与淀粉溶液作用显蓝色的机理如下:
I2跟水发生微弱作用:I2+H2O = H++ I-+ HIO,产生的I-跟I2分子结合:I2+I-= I3-。产物I3-具有直线型结构,而淀粉是很长的链状有机高分子,它在水里呈卷曲的螺旋状结构(通过分子链中各葡萄糖单元上的-OH基团间形成氢键连接),直线型的I3-恰好可以嵌入该螺旋结构内部,形成一个蓝色的复合物。
图示如下:
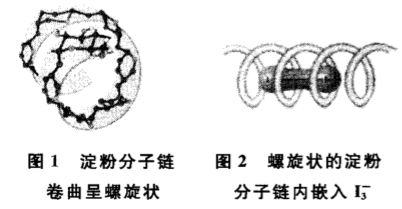
由于淀粉属于高分子化合物,其螺旋链的长短不定,一个淀粉分子链内嵌入几个I3-难以估算,所以此反应一般不写化学方程式。
实验时我们要注意,此反应在常温下是灵敏、有效的,一旦温度升高(大多数文献认为40℃是界限),淀粉分子卷曲的螺旋链会因热运动伸展开来,不能很好地容纳I3-,溶液蓝色即褪去。若把受热褪色的溶液冷却,蓝色又会复现。
所以,在用淀粉溶液检验碘的存在时,要注意温度不可过高。
(2)用湿润的KI-淀粉试纸检验Cl2时,常常出现试纸先变蓝、后褪色的现象。这是为什么呢?
这是因为Cl2的氧化性太强,以至于过量的Cl2把前期置换出的I2单质进一步氧化为HIO3:
5Cl2+I2+6H2O = 10HCl + 2HIO3
有的同学观察到此类现象时,往往把蓝色褪去跟氯水的漂白性联系起来加以解释,其实是不够准确的。
氯水的漂白作用体现在HClO的强氧化性上,它把有机色素分子氧化破坏而漂白,而此处的变化显然不同。
(3)用久置的KI-淀粉试纸检验Cl2等氧化性物质时,为什么常常看到试纸变紫色而非蓝色?
这是因为试纸保存过程中淀粉发生了一定程度的水解,变为糊精。糊精也是高分子化合物,但分子链比淀粉短,跟I3-作用时形成的复合物与淀粉略有不同,呈紫色。所以,用这样的试纸实验时,只要观察到紫色,也说明有I2产生。
3.氟单质能不能跟水反应形成HFO这个物质?
1971年之前,人们从经验主义的观点出发,运用类比思维,认为在HClO中氯呈+1价,而氟无正价,所以次氟酸(HFO)不可能存在。说什么F2与水反应的方程式不能写成:F2+H2O = HF + HFO。
但在1971年,科学家让氟气缓缓通过碎冰末,结果得到了少量次氟酸,说明上述反应是可以成立的。由于氟的电负性比氧大,自然不能认为HFO中氟元素的化合价如HClO中氯一样为+1。
那么,如何理解HFO中氟元素的化合价呢?
让我们从化合价(氧化数)的原始概念出发分析一下:根据价键理论,HFO的结构应该是F—O—H,氧原子分别跟氟原子、氢原子形成一对共用电子,这样分子内各原子均满足最外层的稳定结构。
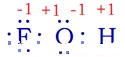
根据氟、氧、氢的电负性可知,氟、氧原子间的电子对偏向于氟,故氟为-1价,而氧对氟显+1价;同时,氧、氢原子间的电子对偏向于氧,故氢为+1价,而氧对氢显-1价。综合考虑,氧的化合价(氧化数)为0。
HFO被发现后,有人根据HFO中氟元素的氧化数为-1提出该酸不能称为次氟酸,而应该叫“氟氧酸”。

- 全部评论(0)
