关于卤族其化合物的系列问题
时间:2021-10-29 08:16 来源:未知 作者:王笃年 点击: 次 所属专题: 卤族
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1、 卤化氢性质 的“规 律”与“特殊 ”
根据元素周期律可 知 ,HF、HCl、HBr、HI随着卤素原子半径增 大 、H—X 键键长增 大 ,分子稳定性减 弱 ,HX的还原性增强。 HF、HCl、HBr、HI中 ,除 HF属 于 中强酸外 ,其他 3种均为强酸 ,从 F到 I,随着 H— X 键的键长增大 ,键的强 度减弱 ,越来越容易电离出 H+ ,故酸性越来越强 (在水溶液里 HCl、HBr、HI的酸性相同 ,均 100%电离 ,但在别的溶剂里如 醋 酸 ,它们的电离程度有差异 ,故有酸性强弱之分 )。 别看 HF是弱酸 ,它却具其他氢卤酸不具备的特殊能力—与 SiO2反应 ,化学方程 式 为 SiO2+4HF=SiF4↑+2H2O。所 以 ,工业上常常利用氢氟酸辅助玻璃雕刻。当然 ,凡事往往有其利必有其弊 ,主要成分为 SiO2的玻璃器皿不能用来盛放氢 氟 酸 ,实验室里氢氟酸 一般都用塑料容器保存 。 有的同学根据 上述反应提出 ,SiO2既 能与 NaOH 溶液反应 ,也能与氢氟酸反应 ,能不能据此说它是两性氧化物呢这是不行的 ! 因为SiO2和 HF的反应中 ,起主要作用的不是 H+ ,而 是因为SiF4 的性质非常稳定 ,易于形成 ,且SiF4 是气体 ,生成后很快从反应体系内逸出 ,推动了反应向右 进行。
2 、为什么循 着 F、Cl、Br、I的 顺 序 。氢卤酸的酸性增 强 ,而最高价含氧酸 (HXO4 )的酸性却减弱 ?
关于HX的酸性 递变规律前边已做阐述。 卤素的最高价含氧酸发生电离时 ,电离掉的都是分子内直接连在氧原子 (一 OH 基 团)上的氢 .对 于不同分子里 的 O— H 键 来 说 ,其强度几乎是一样的 ,在水溶液里是否易电离 ,取决于该 O— H 键的极性如何 ,极性强则易受到溶剂水分子的进攻 ,易电离。HXO4的分子结构可表 示 为 :
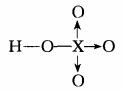 ,
,
不同的卤素原子对 X— O 键上的 电子对吸引程度不同 ,进而使 O— H 键上电子对偏向氧原子的也就程度不同 ,从 Cl到 I,随着非金属性的减弱 ,H— O 键的极性减弱 ,电离程度减小 ,酸性随之减弱 。
3、 Hx气 体 制取 中的一 些 问题
Hx常温下都是 气体 ,属 于挥发性酸 ,所以均可通过卤化物与高沸点 (难挥发)的酸反应来制取。
1)实验室里可用萤石 (CaF2 )与浓硫酸在铅制 容 器里共热制取少量 HF。
CaF2+2H2SO4 Ca(HSO4 )2+2HF↑.
Ca(HSO4 )2+2HF↑.
为什么要用铅制容器而不用玻璃烧瓶呢 ? 因为 HF会与玻 璃 中的含硅物质发生反应而腐蚀玻璃。
2)也可用 浓硫酸与 NaCl反应制取少量 HCl 气体 。
NaC1+H2SO4 NaHSO4+HC1↑(常温或微热);
NaHSO4+HC1↑(常温或微热);
NaCl+NaHSO4 Na2SO4 + HCl↑
Na2SO4 + HCl↑
总反应 2NaCI+H2SO4 Na2SO4+2HCl↑.
Na2SO4+2HCl↑.
3)实验 室 一般 采用 无 强 氧 化 性 的 磷 酸 替代 硫 酸 制取 HBr、HI.
NaBr+H3PO4(浓) HBr↑+Na2HPO4,
HBr↑+Na2HPO4,
KI+H3PO4(浓 ) HI↑+KH2PO4.
HI↑+KH2PO4.
这是因为 HBr、HI的还原性 比 HCl、HF强 ,易被硫酸氧化 .
2HBr+H2SO4=Br2+SO2↑+2H2O,
8HI+ H2SO4=H2S↑+4I2+4H2O.
我们注意到 ,上述制备HX 的反应中 ,无论 是H2SO4 还是 H3PO4,大都生成酸式盐而非正盐 。因为这些多元酸电离掉第 1个 氢比较容易 ,继续电离后边的氢则需要 吸收较多的能量 ,而加热到更高的温度时 ,HBr、HI就容易分解 。
4、 卤化银 的性质与应用 的有关问题
卤化银中 ,除 AgF 性质比较特殊外 ,AgCl、 AgBr、AgI无论物理性质还是化学性质方面 ,均具有很多共性 ,如它们均是有特定颜色的难溶物、均具有感光性等。
AgCl、AgBr、AgI具有特定颜色且不易溶于水 、 不易溶于酸的性质 ,常常被作为特征性质用于鉴定卤素离子的存在。 所谓 AgX 的感光性 ,是指AgX 在 光 照 下不稳定 ,易分解为卤素单质和银。把AgCl、AgBr、AgI在日光下曝晒时都会变黑色 ,说来也许你会吃惊 ,这些黑色固体小颗粒竟然是银。和许多金属 一 样 ,银在晶体状态下是银白色 ,但纳米粒子则呈黑色。卤化银的这 一 性质被用作感光剂 。过去的黑白照片上的黑 色影像就是由银粒子构成的。
卤化银的性质递变规律如下 :

AgF是没有感光性的。试想 ,如果AgF见光也会分解 为F2 和 Ag,那 么历史上制取单质F2 就不用那么大费周折了。AgI还用于人工降雨,其原理是AgI 的微晶结构与冰晶非常相似 ,它可以成为高空云层中水蒸气的聚集核心 ,使缺少结晶核的云层降雨。
5、检验卤素离子时为什么要加 稀硝酸?
和硝 酸银溶液反应形成白色沉淀的离子不只有氯离 子 ,还 有 CO32-、SO42-、SO32-等。同样道理 ,和 Ag+结合形成黄色沉淀的离子也不只有 I-,还有 PO43-等。向 NaCO3、Na3PO4溶 液里别滴加 AgNO3溶 液 ,可以观察到分别形成白色 、黄色沉淀 ; 再向沉淀中分别滴加稀硝酸并振荡 ,沉淀均会溶解 .
2Ag+ +CO32-=Ag2CO3 (白色 ),
3Ag+ +PO43-=Ag3PO4 (黄 色),
Ag2CO3+2H+=2Ag+ + H2O+CO2↑,
Ag3PO4+3H+=3Ag+ + H3PO4.
所以 ,为避免这些离子对卤素离子检验的干扰 , 在检验卤素离时 ,一 般要辅以稀硝酸 。

- 全部评论(0)
