氯气性质实验中的一些问题
时间:2021-10-28 14:33 来源:未知 作者:王笃年 点击: 次 所属专题: 氯气
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1、烟和雾有何不同?为什么H2在Cl2里燃烧时“瓶口处有雾形成”,Na在Cl2里燃烧时“生成大量白烟”,而磷在Cl2里燃烧时则“生成大量白色烟雾”?
由于很难用肉眼辨别烟和雾的不同,文学家对烟和雾往往不详细区分,但化学家不同。在化学领域里,烟和雾都属于气溶胶的范畴,其分散剂均为气体,但分散质不一样,烟是指固体小颗粒弥漫在空气里形成的气溶胶,而雾是小液滴弥漫在空气里形成的。
H2在Cl2里燃烧,产物为极易溶解于水的HCl,它与空气里的水蒸气结合形成盐酸的小液滴,故描述为“白雾”;金属Na、Cu、Fe等在Cl2里燃烧,产物均为固体氯化物颗粒,故描述为“烟”(3种“烟”的颜色不同);而磷和Cl2反应,产物里往往既含有常温下呈液态的PCl3(无色)又含有常温下呈固态的PCl5(白色),两者混合在一起,故描述为“白色烟雾”。
2、为何CuCl2溶液颜色跟CuSO4溶液不同?
CuSO4溶液呈蓝色,这是因为[Cu(H2O)4]2+离子为蓝色.在CuCl2溶液里,存在[Cu(H2O)4)]2+离子的同时,还有另一种离子[CuCl4]2-,该离子呈黄色。
当这2种离子浓度接近的时候,溶液呈现蓝色与黄色的复合色—绿色。若把CuCl2的浓溶液稀释,则蓝色的[Cu(H2O)4]2+离子比例变大而黄色的[CuCl4]2-比例变小,溶液由绿色→蓝绿色→蓝色过渡;相反,若向CuSO4溶液中加固体NaCl搅拌,也会看到溶液颜色由“蓝色→蓝绿色→绿色”过渡过程。

这些实验都很简单,有兴趣同学不妨课余时间做做。
3、常说H2在Cl2中燃烧,H2在O2中燃烧。那么,Cl2能不能“在H2中燃烧呢”?
首先从理论上分析燃烧的本质,所谓燃烧,就是一个发光、放热的剧烈的氧化还原反应过程,只要是H2、Cl2以合理的方式接触,并达到一定的温度(着火点),就可以发生以上发光、放热的剧烈的氧化还原反应。所以,把Cl2通入H2中,并在管口处点燃,理论上二者可持续地发生氧化还原反应并放出大量的热。
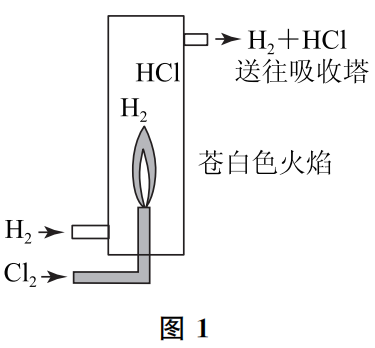
参观盐酸厂可以发现,Cl2在H2中燃烧竟然是事实!从图1中可以看到,从燃烧炉出来的气体成分为HCl和H2的混合物,送到吸收塔用水吸收掉HCl后,不溶解于水的H2经过干燥回到燃烧炉,生产过程很顺利.如果相反,让H2在Cl2中燃烧的话,则从燃烧炉内出来的气体是HCl和Cl2的混合物,用水吸收时,Cl2也会有一部分溶解于水中,这样得到的盐酸就会具有氯水的强氧化性,是不合格的。
由此可见,人们常常把燃烧现象说成是“可燃物(还原剂)”在“助燃物(氧化剂)”中燃烧,只是一种习惯.这与人类早期认识到的燃烧现象,主要是草、木、煤炭等还原性物质在空气里燃烧有关。
4、Cl2和HClO都有强氧化性,氯水能漂白有色物质,为什么一定要说是次氯酸的强氧化性所致?
实验证明干燥的Cl2的确不具有漂白性而氯水具有,这一事实反映出HClO的氧化性比Cl2还要强一些。长期的研究中人们注意到,一切具有漂白性的物质,几乎都是常温下可以自动释放出原子态氧(O)的,如O3、H2O2、Na2O2(水解产生H2O2,H2O2不稳定分解产生(O),(O)相互结合形成O2)等。联系到HClO不稳定,常温下即可分解放出O2的事实,人们自然认定氯水中起漂白作用的是HClO,而非Cl2。
元素的电负性是衡量元素原子得电子能力的重要依据,氧元素的电负性为3.5,而氯元素的电负性为3.0,也说明游离氧原子的氧化性比氯原子要强。
5、根据“氧化剂的氧化性大于氧化产物”,在Cl2与H2O的反应中,氧化剂是Cl2,氧化产物是HClO,能说明Cl2的氧化性强于HClO吗?
氧化剂的氧化性大于氧化产物是对常温下能自发进行的氧化还原反应而言的。氯气在水中的歧化反应是可逆反应,而非进行到底的反应。
经严格的化学热力学计算(查表知![]() (Cl2)=0,
(Cl2)=0,![]() (H2O)=-237kJ·mol-1,
(H2O)=-237kJ·mol-1,![]() (HCl)=-95kJ·mol-1,
(HCl)=-95kJ·mol-1,![]() (HClO)=-66kJ·mol-1,上述正反应的ΔrGθ=
(HClO)=-66kJ·mol-1,上述正反应的ΔrGθ=![]() (HCl)+
(HCl)+![]() (HClO)-
(HClO)-![]() (H2O)=-95kJ·mol-1+(-66kJ·mol-1)-(-237kJ·mol-1)>0,故此反应不属于自发反应,它向右进行的程度很小。)
(H2O)=-95kJ·mol-1+(-66kJ·mol-1)-(-237kJ·mol-1)>0,故此反应不属于自发反应,它向右进行的程度很小。)
可知,该反应常温下逆向自发,而正向非自发,也就是说,在各物质浓度相等的情况下,主要发生HCl+HClO→Cl2+H2O过程,该过程中,氧化剂为HClO,氧化产物为Cl2,故氧化性HClO>Cl2。

- 全部评论(0)
