怎样描述核外电子运动状态?
时间:2021-12-17 10:00 来源:未知 作者:化学自习室 点击: 次 所属专题: 核外电子运动状态
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
围绕在原子核外作高速运动的电子,有它特殊的运动状态。早在本世纪初,科学实验已证明了电子是一种质量为9.11×10-28g的微小粒子,证明了电子的运动具有粒子性。但是,以后科学实验又证明了电子的运动和光、X射线一样具有波动性(图1-4)。这就是说,电子的运动具有波粒二象性。电子运动的这种波粒二象性,使它难以用经典物理学的一些基本定律来描述。
现代研究核外电子运动状态的理论叫做原子波动力学。它是在本世纪20年代末由奥地利物理学家薛定谔等人发展起来的。它的基本方面是一些复杂的数学波动方程,叫做薛定谔方程。核外电子的运动正是通过计算薛定谔方程的解来加以描述的。这里,我们只能按照原子波动力学的基本观点,初步形象地去认识核外电子的运动状态,从而再寻找出原子核外电子的排布有着怎样的规律。
1、 电子云
当人造卫星环绕地球旋转时,我们可以根据一定的数据计算出它在某一时刻的准确位置,描绘出它的运动轨迹。但是,对于核外电子,我们却无法准确计算出它在某一时刻的位置,也不能描绘出它的运动轨迹。在描绘核外电子运动时,只能指出它在原子核外空间各处出现机会的多少。电子在核外空间一定范围内出现,好像是带负电荷的云雾笼罩在原子核的周围。可以形象地称它为“电子云”。核外电子出现机会愈多的区域,电子云的密度愈大。图1-5描绘了氢原子处于基态时的电子云。
氢原子核外只有1个电子,图中的“雾状”,说明氢原子核外电子在一个球形的空间里作高速运动。
图中表示,黑点密集处是电子出现机会多的地方,黑点稀疏处是电子出现机会少的地方。
2 、描述核外电子运动状态的四个方面
对于原子核外的每一个电子的运动状态,都可以从以下四个方面来描述。
(1)电子层
原子核外的电子可以看作是分层排布的。处于不同层次中的电子,离核的远近也不同。离核愈近的电子层能级愈低,离核愈远的电子层能级愈高。通常用n=1、2、3…等数值来表示电子层离核的远近。n=1,即表示离核最近的电子层,其中的电子能量最小。n=2,即表示为第二电子层。有时也用K、L、M、N、O等分别表示1、2、3、4、5等电子层。
我们描述核外电子运动状态时,首先就应描述它处于哪一个电子层。
(2)电子亚层和电子云的形状
即使在同一电子层中的电子,能量也常有差别,它们电子云的形状也不相同。所以每一个电子层,又可以分作几个电子亚层,分别用s、p、d、f等符号来表示。第 1电子层或K层中只包含一个亚层,即s亚层;第2电子层或L层中包含两个亚层,即s和p亚层;在M电子层中包含有三个电子亚层,即s、p、d亚层;在N电子层中,包含着四个电子亚层,即s、p、d、f亚层。不同亚层的电子云形状也不相同,图1-6是s、p两个亚层的电子云示意图。从图中可以看出,s电子云是球形的,p电子云是纺锤形的,d电子云和f电子云的形状较复杂,这里不作介绍。
(3)电子云的伸展方向
电子云不仅有确定的形状,而且有一定的伸展方向。s电子云是球形对称的,在空间各个方向上伸展的程度相同。p电子云如图1-7所示,在空间可以有三种互相垂直的伸展方向。d电子云可以有五种伸展方向,f电子云可以有七种伸展方向。
如果把在一定电子层上,具有一定形状和伸展方向的电子云所占据的空间称为一个轨道,那么s、p、d、f四个亚层就分别有1、3、5、7个轨道。这样,各电子层可能有的最多轨道数如下:
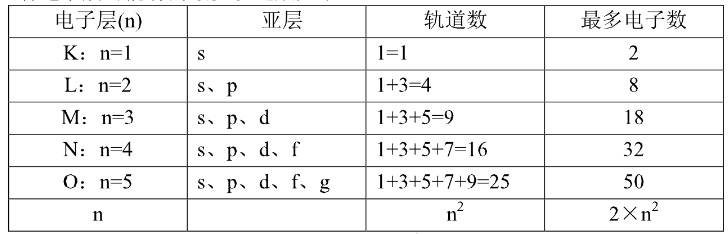
每个电子层可能有的最多轨道数应为2n2。
(4)电子的自旋
电子不仅在核外空间不停地运动,而且还作自旋运动。电子自旋有两种状态,相当于顺时针和逆时针两种方向。常用向上箭头“↑”和向下箭头“↓”来表示不同的自旋状态。
综上所述,可见电子在原子核外的运动状态是相当复杂的,必须通过它所处的电子层、电子亚层、电子云的空间伸展方向和自旋状态四个方面来描述。前三个方面跟电子在核外空间的位置有关,体现了电子在核外空间的运动状态,确定了电子的轨道。因此,当我们要说明一个电子的运动状态时,必须同时指明它处于什么轨道和哪一种自旋状态。

- 全部评论(0)
