升高温度,化学反应速率一定增大吗?
时间:2022-03-07 11:40 来源:未知 作者:化学自习室 点击: 次 所属专题: 影响反应速率因素
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
问题:升高温度,化学反应速率一定增大吗?
答:山东科技版《化学反应原理》第60页指出:“阿伦尼乌斯(Arrhenius)在大量实验事实的基础上,提出了反应速率常数与温度之间关系的经验公式:
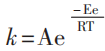
该经验公式表明,当Ea>0时,升高温度,反应速率常数增大,化学反应速率随之增大。一般化学反应速率随温度的升高而加快,但是,2NO + O2 = 2NO2的反应速率却随温度的升高而下降,如何解释这一事实?
实际上,各种化学反应的速率随温度的变化关系是比较复杂的,除满足Arrhenius公式的反应外,还存在着其他类型的反应速率与温度的依赖关系。大致可分为如下图所示的几种情况。
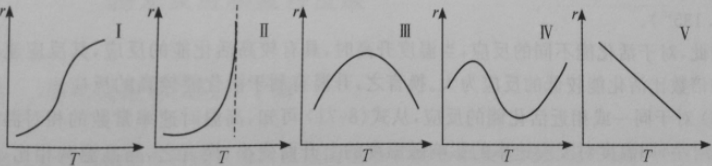
第Ⅰ种类型的反应速率随温度的升高而逐渐加快,它们之间呈指数关系,符合Arrhenius公式,这类反应最为常见。第Ⅱ种类型的反应,在低温时反应速率较慢,基本符合Arrhenius方程。但当温度到达某一定临界值时,反应速率迅速增大,反应以爆炸的方式极快地进行。
在第Ⅲ种类型中,在温度不太高时,速率随温度的升高而加快,但到达某一温度后,速率反而下降。这类反应常见于多相催化反应和酶催化反应。
第Ⅳ类型的反应,速率随温度升到某一高度后下降,但在某一温度后再升高温度,速率则又迅速上升,此时可能发生了副反应。
第Ⅴ种类型的反应是反常的情况,即随着温度升高速率反而下降。这种类型很少,NO氧化成NO2的反应属于此种类型。文献表明,2NO + O2 = 2NO2的反应不是基元反应,总反应的活化能为―40 kJ•mol-1。若根据Arrhenius公式,当Ea<0时,随着温度的升高,k值减小。也就是说,上述反应的速率随温度的升高而下降。
(责任编辑:化学自习室)

说点什么吧
- 全部评论(0)
还没有评论,快来抢沙发吧!
